
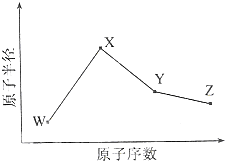
 W”¢X”¢Y”¢ZŹĒĖÄÖÖ³£¼ūµÄ¶ĢÖÜĘŚŌŖĖŲ£¬ĘäŌ×Ó°ė¾¶ĖęŌ×ÓŠņŹż±ä»ÆČēĶ¼ĖłŹ¾£®ŅŃÖŖWµÄŅ»ÖÖŗĖĖŲµÄÖŹĮæŹżĪŖ18£¬ÖŠ×ÓŹżĪŖ10£»XŗĶNeŌ×ÓµÄŗĖĶāµē×ÓŹżĻą²ī1£»YµÄµ„ÖŹŹĒŅ»ÖÖ³£¼ūµÄ°ėµ¼Ģå²ÄĮĻ£»ZµÄµēøŗŠŌŌŚĶ¬ÖÜĘŚÖ÷×åŌŖĖŲÖŠ×ī“ó£®
W”¢X”¢Y”¢ZŹĒĖÄÖÖ³£¼ūµÄ¶ĢÖÜĘŚŌŖĖŲ£¬ĘäŌ×Ó°ė¾¶ĖęŌ×ÓŠņŹż±ä»ÆČēĶ¼ĖłŹ¾£®ŅŃÖŖWµÄŅ»ÖÖŗĖĖŲµÄÖŹĮæŹżĪŖ18£¬ÖŠ×ÓŹżĪŖ10£»XŗĶNeŌ×ÓµÄŗĖĶāµē×ÓŹżĻą²ī1£»YµÄµ„ÖŹŹĒŅ»ÖÖ³£¼ūµÄ°ėµ¼Ģå²ÄĮĻ£»ZµÄµēøŗŠŌŌŚĶ¬ÖÜĘŚÖ÷×åŌŖĖŲÖŠ×ī“ó£®·ÖĪö W”¢X”¢Y”¢ZŹĒĖÄÖÖ³£¼ūµÄ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×Ó°ė¾¶X£¾Y£¾Z£¾W£»WµÄŅ»ÖÖŗĖĖŲµÄÖŹĮæŹżĪŖ18£¬ÖŠ×ÓŹżĪŖ10£¬ĘäÖŹ×ÓŹżĪŖ8£¬ŌņWŹĒOŌŖĖŲ£»
XŗĶNeŌ×ÓµÄŗĖĶāµē×ÓŹżĻą²ī1£¬ĘäŌ×Ó°ė¾¶×ī“ó£¬ĪŖNaŌŖĖŲ£»
YµÄµ„ÖŹŹĒŅ»ÖÖ³£¼ūµÄ°ėµ¼Ģå²ÄĮĻ£¬ŌņYŹĒSiŌŖĖŲ£»
ZµÄµēøŗŠŌŌŚĶ¬ÖÜĘŚÖ÷×åŌŖĖŲÖŠ×ī“ó£¬ĒŅĘäŌ×Ó°ė¾¶“óÓŚOŌŖĖŲ£¬ŌņZŹĒClŌŖĖŲ£»
½įŗĻĢāÄæ·ÖĪö½ā“š£®
½ā“š ½ā£ŗW”¢X”¢Y”¢ZŹĒĖÄÖÖ³£¼ūµÄ¶ĢÖÜĘŚŌŖĖŲ£¬Ō×Ó°ė¾¶X£¾Y£¾Z£¾W£»WµÄŅ»ÖÖŗĖĖŲµÄÖŹĮæŹżĪŖ18£¬ÖŠ×ÓŹżĪŖ10£¬ĘäÖŹ×ÓŹżĪŖ8£¬ŌņWŹĒOŌŖĖŲ£»
XŗĶNeŌ×ÓµÄŗĖĶāµē×ÓŹżĻą²ī1£¬ĘäŌ×Ó°ė¾¶×ī“ó£¬ĪŖNaŌŖĖŲ£»
YµÄµ„ÖŹŹĒŅ»ÖÖ³£¼ūµÄ°ėµ¼Ģå²ÄĮĻ£¬ŌņYŹĒSiŌŖĖŲ£»
ZµÄµēøŗŠŌŌŚĶ¬ÖÜĘŚÖ÷×åŌŖĖŲÖŠ×ī“ó£¬ĒŅĘäŌ×Ó°ė¾¶“óÓŚOŌŖĖŲ£¬ŌņZŹĒClŌŖĖŲ£»
£Ø1£©XŹĒNaŌŖĖŲ£¬NaŌ×ÓŗĖĶāÓŠ3øöµē×Ó²ć”¢×īĶā²ćµē×ÓŹżĪŖ1£¬ĖłŅŌĪ»ÓŚµŚČżÖÜĘŚµŚIA×壬¹Ź“š°øĪŖ£ŗµŚČżÖÜĘŚµŚIA×壻
£Ø2£©WŹĒOŌŖĖŲ£¬ĘäŗĖĶāµē×ÓÅŲ¼Ź½ĪŖ£ŗ1s22s22p4£¬ĘäŌ×ÓŗĖĶāÓŠ2øöĪ“³É¶Ōµē×Ó£¬¹Ź“š°øĪŖ£ŗ2£»
£Ø3£©YŹĒSiŌŖĖŲ”¢ZŹĒClŌŖĖŲ£¬Ķ¬Ņ»ÖÜĘŚŌŖĖŲ£¬ŌŖĖŲµÄ·Ē½šŹōŠŌĖę×ÅŌ×ÓŠņŹżŌö“ó¶ųŌöĒ棬ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬Ę䵄֏µÄ»īĘĆŠŌŌ½Ē棬ĖłŅŌYµ„ÖŹŗĶZµ„ÖŹĻą±Č£¬½Ļ»īĘƵďĒCl2£¬ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬ĘäĒā»ÆĪļµÄĪČ¶ØŠŌŌ½Ē棬·Ē½šŹōŠŌCl£¾Br£¬ĖłŅŌĒā»ÆĪļ½ĻĪČ¶ØµÄŹĒHCl£»
¹Ź“š°øĪŖ£ŗCl2£»HCl£»
£Ø4£©YŹĒSiŌŖĖŲ”¢ZŹĒClŌŖĖŲ£¬¶žÕߊĪ³ÉµÄĪļÖŹŹĒĖÄĀČ»Æ¹č£¬ĖÄĀČ»Æ¹čŗĶĖ®·“Ӧɜ³É¹čĖįŗĶHCl£¬·“Ó¦·½³ĢŹ½ĪŖSiCl4+3H2O=H2SiO3”ż+4HCl£¬
¹Ź“š°øĪŖ£ŗSiCl4+3H2O=H2SiO3”ż+4HCl£»
£Ø4£©YµÄĒā»ÆĪļŹĒ¹čĶ飬¹čĶéŗĶŃõĘų·“Ó¦·½³ĢŹ½ĪŖSiH4+2O2=SiO2+2H2O£¬øĆ·“Ó¦ÖŠ×ŖŅʵē×ÓŹżĪŖ8£¬Ę½¾łĆæ×ŖŅĘ1mol µē×Ó·ÅČČ190.0kJ£¬Ōņ×ŖŅĘ8molµē×ӷųöČČĮæ1520.0KJ£¬ŌņĘäČČ»Æѧ·½³ĢŹ½ĪŖSiH4£Øg£©+2O2£Øg£©=SiO2£Øs£©+2H2O£Øl£©”÷H=-1520.0KJ/mol£¬
¹Ź“š°øĪŖ£ŗSiH4£Øg£©+2O2£Øg£©=SiO2£Øs£©+2H2O£Øl£©”÷H=-1520.0KJ/mol£®
µćĘĄ ±¾Ģāæ¼²éĪ»ÖĆ½į¹¹ŠŌÖŹµÄĻą»„¹ŲĻµ¼°Ó¦ÓĆ£¬ĪŖøßĘµæ¼µć£¬Éę¼°ČČ»Æѧ·½³ĢŹ½µÄŹéŠ“”¢ŌŖĖŲÖÜĘŚĀÉ”¢Ō×Ó½į¹¹µČÖŖŹ¶µć£¬Ć÷Č·Ō×Ó½į¹¹”¢ŌŖĖŲÖÜĘŚ±ķ½į¹¹”¢ŌŖĖŲ»ÆŗĻĪļŠŌÖŹµČÖŖŹ¶µćŹĒ½ā±¾Ģā¹Ų¼ü£¬²ąÖŲæ¼²éѧɜ·ÖĪöÅŠ¶Ļ¼°ÖŖŹ¶×ŪŗĻŌĖÓĆÄÜĮ¦£¬×¢Ņā»ł“”ÖŖŹ¶µÄ×ܽį¹éÄÉ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH4NO3 | B£® | SiO2 | C£® | C6H5NO2 | D£® | Cu |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| ” | ¢Ł | ¢Ś | ¢Ū | |
| ” | ¢Ü | ¢Ż |
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
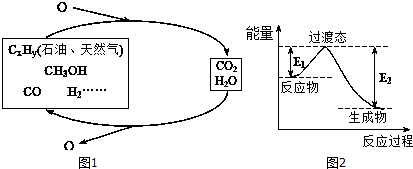
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| ŹµŃé | ĪĀ¶Č/”ę | ĘšŹ¼Įæ | “ļµ½Ę½ŗā | |||
| CO/mol | H2O/mol | H2/mol | CO×Ŗ»ÆĀŹ | ĖłŠčŹ±¼ä/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 1/3 | 3 | |
| 3 | 900 | a | b | c | t | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ¢Ł | ¢Ś | ||||||
| 3 | ¢Ū | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą | ||
| 4 | ¢į | ¢ā |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹÆÓ¢ČÜÓŚÉÕ¼īČÜŅŗ£ŗSiO2+2OH-ØTSiO32-+H2O | |
| B£® | ĒāŃõ»ÆÄĘČÜŅŗÖŠĶØČėÉŁĮæµÄ¶žŃõ»ÆĮņ£ŗSO2+OH-ØTHSO3- | |
| C£® | Ģ¼ĖįĒāøĘČÜŅŗÖŠ¼ÓČė×ćĮæĒāŃõ»ÆÄĘČÜŅŗ£ŗCa2++HCO3-+OH-ØTCaCO3”ż+H2O | |
| D£® | äå»ÆŃĒĢśČÜŅŗÖŠĶØČėÉŁĮæĀČĘų£ŗ2Fe2++4Br-+3Cl2ØT2Fe3++2Br2+6Cl- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com