
用含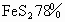 的硫铁矿制硫酸,若煅烧时损失6%的硫元素,由二氧化硫制三氧化硫的转化率为98%.则制取1t纯硫酸需这种硫铁矿多少吨?
的硫铁矿制硫酸,若煅烧时损失6%的硫元素,由二氧化硫制三氧化硫的转化率为98%.则制取1t纯硫酸需这种硫铁矿多少吨?
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:教材完全解读 苏教版课标版 高中化学 必修1 苏教版课标版 题型:038
用含FeS2 78%的硫铁矿制硫酸,若煅烧时损失6%的硫元素,由二氧化硫制三氧化硫的转化率为98%,则制取1 t纯硫酸需这种硫铁矿多少吨?
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闸北区高三上学期期末考试化学试卷(解析版) 题型:填空题
硫铁矿又称黄铁矿(主要成分FeS2,杂质不含硫元素),是地壳中分布最广的硫化物。因其浅黄的颜色和明亮的金属光泽,常被误认为是黄金,故又称“愚人金”。
工业上硫铁矿主要用于接触法制造硫酸,其反应原理为:
①FeS2与O2高温下反应生成SO2;
②SO2在催化剂作用下与O2反应生成SO3;
③SO3与H2O反应生成H2SO4.
(1)若1.00吨 SO2与O2的混合气体中含SO2 0.40吨,在一定条件下发生反应②,有80%的SO2发生转化,则反应后混合气体中SO3的质量分数是_________。
(2)现用80吨硫铁矿制硫酸,最后生产出100吨98%的硫酸。若反应过程中硫元素的损失率为5%,则硫铁矿中FeS2的质量分数为__________________。
(3)在浓硫酸中继续溶解SO3后所形成的液体称发烟硫酸,其浓度通常以游离的SO3含量来表示,如20%的发烟硫酸即表示在硫酸中含有20%的SO3。现有1L含SO330%的发烟硫酸(密度为1.95g/cm3),要把它稀释成质量分数为95%的浓硫酸,需加水约多少?(写出计算过程)
(4)已知:850℃~900℃时,硫铁矿在氧气中煅烧,可能发生下列反应:
①3FeS2+8O2→Fe3O4+6SO2
②4FeS2+11O2→2Fe2O3+8SO2
为使FeS2煅烧完全生成Fe2O3,工业上使用过量氧气,当氧气过量20%时,求所得炉气中SO2的体积分数。(写出计算过程)
57.将480 g纯净的FeS2在氧气中完全反应,若所得固体中n(Fe)∶n(O)=4∶a,此时消耗氧气b mol,试写出b与a的关系式_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com