
| A. | 1molCl2与Fe粉完全反应时转移电子数为2NA | |
| B. | 过氧化钠与水反应时,每生成1molO2,转移4mol电子 | |
| C. | 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA | |
| D. | 0.1 mol•L-1NaHSO4溶液中,阳离子数目之和为0.3NA |
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:填空题
(1) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A,根据题意回答下列问题:
①写出酸H2A的电离方程式__________________。
②若溶液M由10mL 2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液M中各微粒的浓度关系正确的是__________。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2) CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______________,其水解反应的平衡常数(即水解常数)的表达式为Kh=__________。
②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=__________。
③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=__________(用含c(HCO3-)、c(H2CO3)的关系式表示)
④向 Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式__________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH 的水溶液与 0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为__________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1),可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断NaHSO3溶液显____性,用化学平衡原理解释:______________________。
②当吸收液呈中性时,溶液中出离子浓度关系正确的是(选填字母)_________________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性高锰酸钾溶液 | |
| 体积(mL) | 浓度(mol/L) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第 1 次 | 第 2 次 | 第 3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 2 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释、结论 |
| A | 长期露置于潮湿空气中的Fe粉中加入足量的稀盐酸充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀盐酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | Al箔插入浓硝酸中 | 无现象 | Al在浓硝酸中钝化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到蓝色石蕊试纸上 | 试纸变红色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
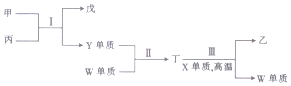
| A. | 原子半径:X<Y<Z | |
| B. | 反应Ⅰ中丙既能做氧化剂又作还原剂 | |
| C. | 非金属性:X>Y>W | |
| D. | 反应Ⅱ和Ⅲ反应均属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅣA族元素氢化物沸点:SiH4>CH4,所以ⅤA族元素氢化物沸点:PH3>NH3 | |
| B. | 第二周期元素氢化物稳定性:HF>H2O,第三周期元素氢化物稳定性:HCl>H2S | |
| C. | ⅦA族元素的非金属性:F>Cl,所以ⅦA族元素氢化物的酸性:HF<HCl | |
| D. | 镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R可能为乙二酸 | |
| B. | N可能为对苯二甲酸 | |
| C. | 高聚物M为加聚产物 | |
| D. | 含有羧基的物质在常温下均易溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com