
 化工工业中常用乙苯脱氢的方法制备苯乙烯.
化工工业中常用乙苯脱氢的方法制备苯乙烯. (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;①②的化学反应平衡常数分别为K1、K2,
(g)+H2(g),△H=+117.6kJ/mol;①②的化学反应平衡常数分别为K1、K2, (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol该反应的化学平衡常数K=K1•K2(用K1、K2表示)
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol该反应的化学平衡常数K=K1•K2(用K1、K2表示)分析 (1)根据盖斯定律,结合已知方程式计算反应热,然后写热化学方程式;方程式相加时,总平衡常数等于分方程的平衡常数之积;
(2)A、升高温度正逆反应速率均增大;
B、增大反应物,平衡正向移动;
C、若继续通入1mol CO2则平衡向正反应方向移动;
D、压缩体积,平衡不移动,反应物和产物的浓度都增大;
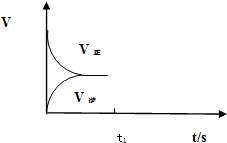
(3)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大.
解答 解:(1)已知反应①:CO2(g)+H2(g)→CO(g)+H2O(g),△H=+41.2kJ/mol;
反应②: (g)→
(g)→ (g)+H2(g),△H=+117.6kJ/mol;
(g)+H2(g),△H=+117.6kJ/mol;
根据盖斯定律:①+②,得 CO2(g)+ (g)+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol;
(g)+CO(g)+H2O(g)△H=+41.2+117.6=+158.8kJ/mol;
反应①与法院②相加得总方程,则总方程的平衡常数等于分方程的平衡常数之积,即K=K1•K2;
故答案为:CO2(g)+ (g)+CO(g)+H2O(g) △H=+158.8 kJ/mol;K1•K2;
(g)+CO(g)+H2O(g) △H=+158.8 kJ/mol;K1•K2;
(2)A、升高温度增大了活化分子百分数,有效碰撞几率增大,正逆反应速率均增大,故A错误;
B、若再加入1molCO2、1mol H2,平衡正向移动,故B错误;
C.若再加入CO2则平衡向正反应方向移动,CO的体积分数增加,故C错误;
D.若充入He,各物质浓度不变,平衡不移动,反应物和产物的浓度都不变,故D正确.
故选D.
(3)恒温恒容条件下,反应①达到平衡后;t1时刻通入少量CO2,则正反应速率瞬间增大,逆反应速率逐渐增大,其t1之后的正逆反应曲线为: ,故答案为:
,故答案为: .
.
点评 本题考查了热化学方程式的书写、平衡常数K的应用、影响速率及平衡的因素、Ksp的计算、电解原理的应用等,题目涉及的知识点较多,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 在标准状况下,22.4 LCH4与18 g H2O所含有的电子数均为10NA | |
| C. | 22.4 L CO气体与l molN2所含的电子数相等 | |
| D. | 1 mol HCl气体中的分子数与2L0.5 mo1/L盐酸中溶质分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖水瓶中的薄层水垢 | B. | 石油的分馏和煤的干馏 | ||
| C. | 用二氧化氯(ClO2)为自来水消毒 | D. | 液氨作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
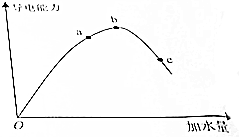 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com