
| A. | 任何条件下,16gCH4与18 g H2O所含有电子数均为10NA | |
| B. | 19g的H3O+离子中含有的电子数为11NA | |
| C. | 0.5mol/LH2SO4中的H+数为NA | |
| D. | 22.4 L的CO气体与1 mol N2所含的电子数相等 |
分析 A.甲烷和水分子中含有含有10个电子,根据n=$\frac{m}{M}$计算出二者的物质的量,然后计算出含有电子的物质的量及数目;
B.H3O+中含有10个电子,根据n=$\frac{m}{M}$计算出其物质的量,然后计算出含有电子的物质的量及数目;
C.缺少硫酸溶液体积,无法计算含有氢离子的数目;
D.不是标况下,无法计算一氧化碳的物质的量.
解答 解:A.16gCH4与18 g H2O的物质的量都是1mol,1mol二者分子中都含有10mol电子,所含有电子数均为10NA,故A正确;
B.19g的H3O+离子的物质的量为1mol,1mol该离子中含有10mol电子,含有的电子数为10NA,故B错误;
C.没有告诉0.5mol/LH2SO4溶液的体积,无法计算含有氢离子的数目,故C错误;
D.不是标准状况下,不能使用标况下的气体摩尔体积计算,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度不大,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═2Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
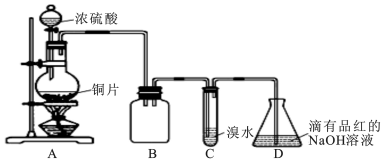
| 序号 | 实验操作 | 预期现象及结论 |
| ① | 取上述混合溶液于试管A中,加入少量CaCO3固体,充分振荡. | 若固体溶解,产生气泡,则Ⅰ或Ⅱ成立. |
| ② | 继续向试管A中滴加溴水,充分振荡. | 若溶液褪色,结合步骤①,则Ⅱ成立;若溶液不褪色,结合步骤①,则Ⅰ成立 |
| ③ | 另取上述混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡. | 溶液变为蓝色,则Ⅲ成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒 | |
| B. | 将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外 | |
| C. | 用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切 | |
| D. | 用胶头滴管加水时,俯视观察溶液凹液面与容量瓶刻度相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下将铁块放入浓H2SO4中 | 无明显现象发生 | 铁常温下与浓H2SO4不反应 |
| B | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均发生了分解 |
| C | 氯水滴入混有KSCN的FeCl2溶液 | 溶液显红色 | 该氯水不具有漂白性 |
| D | 向溶液Y中先加盐酸酸化,无现象,再加入BaCl2溶液 | 白色沉淀 | Y中一定含SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积相同,浓度都为 0.1 mol•L-1的盐酸和醋酸分别与体积相同 2 mol•L-1的NaOH溶液反应,两者速率相同 | |
| B. | 用锌和稀硫酸反应制取氢气时,加入少量硫酸铜固体会使生成氢气的速率加快 | |
| C. | Mg粉和Al粉分别与0.1 mol•L-1的NaOH溶液反应,Mg粉反应速率快 | |
| D. | 相同温度下,大理石块与大理石粉分别与盐酸反应,大理石块的反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于2HI(g)?H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| D. | 冰镇的啤酒打开后泛起泡沫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com