
| A. | 质量数为35的氯原子:35Cl | B. | 氟原子的结构示意图: | ||
| C. | 氯化铵的电子式: | D. | 明矾的化学式:Al2(SO4)3 |
分析 A.元素符号的左上角为质量数;
B.氟原子的核电荷数=核外电子总数=9,最外层含有7个电子;
C.铵根离子为复杂阳离子,电子式中需要标出N、H原子的最外层电子;
D.明矾为十二水合硫酸铝钾,漏掉了明矾的12个结晶水.
解答 解:A.质量数为35的氯原子可以表示为:35Cl,故A正确;
B. 为氟离子结构示意图,氟原子的核电荷数=核外电子总数=9,其正确的原子结构示意图为
为氟离子结构示意图,氟原子的核电荷数=核外电子总数=9,其正确的原子结构示意图为 ,故B错误;
,故B错误;
C.氯化铵为离子化合物,铵根离子和氯离子都需要标出所带电荷及最外层电子,正确的电子式为 ,故C错误;
,故C错误;
D.明矾中含有结晶水,明矾正确的化学式为KAl(SO4)2•12H2O,故D错误;
故选A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及原子结构示意图、元素符号、电子式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
 乙醇与乙酸的酯化反应如图所示,回答问题:
乙醇与乙酸的酯化反应如图所示,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 光照条件下1molCH4与3molCl2反应可制得1molCHCl3 | |
| C. |  为苯分子的比例模型 为苯分子的比例模型 | |
| D. |  所有碳原子有可能都在同一个平面上 所有碳原子有可能都在同一个平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X 中肯定存在 Fe2+、A13+、NH4+、SO42- | |
| B. | X中不能确定是否存在的离子是Al3+和Cl- | |
| C. | 溶液E和气体F发生反应,生成物为盐类 | |
| D. | 气体A是NO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaBr.
+2NaBr.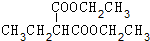 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用铁触媒,加快合成氨反应速率 | B. | 实验室用排饱和食盐水法收集氯气 | ||
| C. | 打开汽水瓶盖,即有大量氕泡逸出 | D. | 温度升高,纯水中的H+浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com