����ѧ--ѡ��2����ѧ�뼼��������ˮ����������ʾ��ͼ���£�

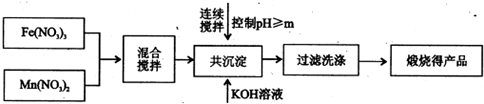
��1����������ȥ�������ʵĹ���
��
��
����д��ţ�
��ֻ�������仯 ��ֻ�ǻ�ѧ�仯 ���������ͻ�ѧ�仯
FeSO
4?7H
2O�dz��õĻ�����������ˮ����������
Fe��OH��3
Fe��OH��3
������
��2����Ҫ��ȥCa
2+��Mg
2+������ˮ�м���ʯ�Һʹ���Լ����ʱ�ȼ�
ʯ��
ʯ��
���
����
����
��ԭ����
�����ĸ����ӿ�ͨ������ʹ֮��������
�����ĸ����ӿ�ͨ������ʹ֮��������
��
��3����������������Ϊ����ˮ��Ӧ������HClO���������ǿ��������ɱ��ˮ�еIJ���������ֱ���ô�����Ϊ����ˮ��������Ϊ�������ֽ⣬�Ҷ��Խϴ�
Cl
2+H
2O?HCl+HClO K=4.5��10
-4ʹ������Ϊ����ˮ����������Ч�ؿ��ƴ������Ũ�ȣ�����ƽ�ⳣ������ԭ��
��������ˮ��Ӧ��ƽ�ⳣ����֪���÷�Ӧ���Ⱥ�С�����ɵ�HClOŨ�Ⱥ�С��������HClO�����ģ�ƽ����������Ӧ�ƶ�������HClO
��������ˮ��Ӧ��ƽ�ⳣ����֪���÷�Ӧ���Ⱥ�С�����ɵ�HClOŨ�Ⱥ�С��������HClO�����ģ�ƽ����������Ӧ�ƶ�������HClO
������������
�٢�
�٢�
������Ϊ�����Ĵ���Ʒ����д��ţ���
�ٳ��� ��NH
3��Һ�� ��K
2FeO
4 ��SO
2��4����Щ��������Ȼˮ�к��н϶�ĸơ�þ���ӣ������ӽ�����֬����Ӳˮʱ���Ⱥ��ˮͨ���ֱ�װ��
��
��
���ӽ�����֬��
��
��
���ӽ�����֬�����ӽ�������������������������ӽ�����֬ΪHR�ͣ������ӽ�����֬ΪR��OH�ͣ���
��5���ⶨˮ�е��ܽ�������ȡ40mLˮ����Ѹ�ټ���MnSO
4��KOH�����Һ���ټ���KI��Һ�������������ӣ���ʹ��ȫ��Ӧ�������ӣ�Ѹ�ټ�������������Һ����ʱ�еⵥ�����ɣ���0.010mol/LNa
2S
2O
3��Һ�ζ����ɵĵ⣬������6.00mL Na
2S
2O
3��Һ����֪�ڼ�����Һ�У�������Ѹ������Mn
2+�������������������¿��Խ�����������Ϊ�ⵥ�ʣ��������»�ԭΪMn
2+���������̷����ķ�Ӧ�ɱ�ʾΪ��2Mn
2++4OH
-+O
2=2MnO��OH��
2 MnO��OH��
2+2I
-+4H
+=I
2+Mn
2++3H
2O I
2+2S
2O
32-=2I
-+S
4O
62- ��ˮ�е��ܽ�����Ϊ
12.0
12.0
mg?L
-1��

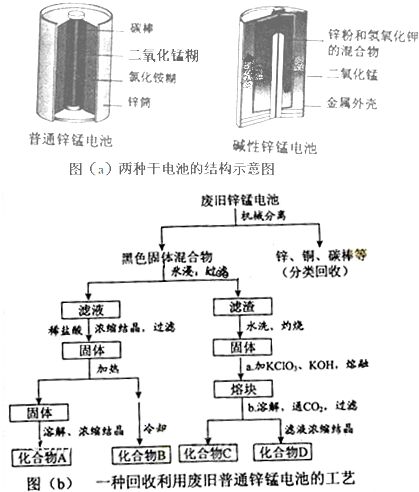


 �ľ�ͼ���ʱ�ȷ�ϵ�д�
�ľ�ͼ���ʱ�ȷ�ϵ�д�