
下 列反应所得溶液中一定只含一种溶质的是( )
列反应所得溶液中一定只含一种溶质的是( )
A.向稀硝酸中加入铁粉
B.向氯化铝溶液中加入过量的氨水
C.向NaOH溶液中通入CO2气体
D.向MgSO4、H2SO4的混合液中加入过量的Ba(OH)2溶液
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:填空题
在标准状况下,4.48LC2H4气体的物质的量为 mol,质量为 g,分子数为 个,含有 mol电子。含有 mol H原子,H 原子的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:选择题
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是:
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
③Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
④Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑤Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
A.①③⑥ B. ②③⑤ C.①②⑤ D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期9月月考化学试卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系: 。下列有关物质的推断不正确的是( )
。下列有关物质的推断不正确的是( )
A.若甲为AlCl3溶液,则丁可能是NaOH溶液
B.若甲为氮气,则丁可能是O2
C.若甲为Fe,则丁可能是稀硝酸
D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期9月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO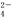
B.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
C.水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
D.使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期9月月考化学试卷(解析版) 题型:选择题
分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )
A.冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物
B.HCl O、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸
O、H2SO4(浓)、HNO3均具有强氧化性,都是氧化性酸
C.漂白粉、福尔马林、冰水、王水、氯水均为混合物
D. Na2O,NaOH,Na2CO3,NaCl,Na2SO4,Na2O2都属于钠的含氧化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:填空题
在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:A(g)+2B(g) 3C(g),达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
3C(g),达到平衡后生成1.2 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol。
请回答下列问题
(1)该反应的平衡常数K随温度升高而 (填“增大”、“减少”或“不变”),该反应的焓变△H 0(填“>”、“<”或“=”)。
(2)30℃时,平衡混合气中C的体积分数ω= ,A物质的转化率与B物质的转化率之比为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上开学考试化学卷(解析版) 题型:实验题
实验室用密度1.18g/mL、质量分数为36.5%的浓盐酸配制500mL 0.1 mol/L 的盐酸,回答下列问题:
(1)配制500mL 0.1 mol/L 的盐酸
应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
(2)配制时,正确的操作顺序是 (填编号)。
A用适量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B 用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌,使其混合均匀
C 将已冷却的溶液沿玻璃棒注入所选容量瓶中
D 盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F 继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(3)操作A中,将洗涤液都注入容量瓶,其目的是 ,若无操作A ,则所配溶液浓度 (填“偏大”、“偏小”或“不变”)
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度 (填“偏大”、“偏小”或“不变”),应如何处理 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第二次月考化学试卷(解析版) 题型:填空题
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1 MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
平衡时CO的转化率与温度、压强的关系如下图:

(ⅰ)该反应属于___________反应(填“吸热”或“放热”)。
(ⅱ)100 ℃时,若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是___________(填序号)。
a.该反应使用催化剂意义不大
b.该反应发生将在很短的时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
(ⅲ)在温度和容积不变的情况下,再向平衡体系中充入a mol CO、2a mol H2,达到平衡时CO的转化率___________(填“增大”、“不变”或“减小”,下同),平衡常数___________。
(ⅳ)在某温度下,向一容积不变的密闭容器中充入2.5 mol CO、7.5 mol H2,反应生成CH3OH(g)达到平衡时,CO的转化率为90%,此时容器内压强为开始时压强的___________倍。
(2)某温度下,若将CO2(g)和H2(g)以体积比1∶4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO2(g)和H2(g)反应生成甲烷和液态水的热化学方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com