
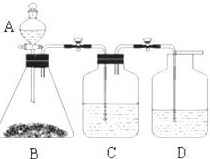
 为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验:
为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验:分析 (1)遵循强酸制取弱酸的反应原理,验证醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,将CH3COOH与Na2CO3发生反应:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,说明酸性CH3COOH>H2CO3;产生的CO2气体先通过饱和的碳酸氢钠溶液除去混有的醋酸蒸汽,然后再通入苯酚钠溶液发生反应C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 ,说明酸性H2CO3>C6H5OH;
(2)根据醋酸的性质、制取的二氧化碳的性质判断,乙酸易挥发,生成的二氧化碳中含有乙酸蒸气,比较H2CO3、C6H5OH的酸性强弱,需排除乙酸的干扰,即需洗去二氧化碳中的乙酸;
(3)根据二氧化碳和苯酚钠反应的生成物确定现象,苯酚钠和二氧化碳和水反应生成苯酚和碳酸氢钠,苯酚在冷水中溶解度小.
解答 解:(1)醋酸和碳酸都是弱酸,但相同浓度的醋酸和碳酸,醋酸的电离程度比碳酸强,所以醋酸的酸性比碳酸强;根据强酸制弱酸的特点,所以醋酸能和碳酸钠反应生成碳酸,碳酸不稳定能分解生成水和二氧化碳,将CH3COOH与Na2CO3发生反应:Na2CO3+2CH3COOH=2CH3COONa+H2O+CO2↑,能说明酸性CH3COOH>H2CO3,所以装置A、B中盛放的试剂分别是CH3COOH、Na2CO3,
故答案为:CH3COOH;Na2CO3;
(2)醋酸具有挥发性,所以制取的二氧化碳中含醋酸,为防止醋酸对二氧化碳的干扰,必须先除去醋酸;因为CO2+H2O?H2CO3?H++HCO3-,如果溶液中含有HCO3-能抑制二氧化碳的溶解,且碳酸氢盐能和醋酸反应生成二氧化碳,不引进新的杂质,所以装置C中盛放的试剂是饱和NaHCO3 溶液,它的作用是除去混有的醋酸.
故答案为:饱和NaHCO3 溶液;除去CO2 中混有的CH3COOH;
(3)如果向澄清的苯酚钠溶液中通入二氧化碳气体,可以看到澄清的苯酚钠溶液变浑浊,原因是苯酚钠和水、二氧化碳反应生成苯酚和碳酸氢钠,苯酚在水中的溶解度不大,所以看到溶液变浑浊,
故答案为:溶液变浑浊;C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 .
点评 本题考查了酸性强弱比较的实验方法,电解质的强弱与电离程度有关,与溶液中离子的浓度无关,注意苯酚钠和水、二氧化碳反应的生成物是碳酸氢钠不是碳酸钠,注意:醋酸有挥发性,导致制取的二氧化碳中含有醋酸,干扰实验,为易错点,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3和NaHCO3的混合溶液中(S和C均用R表示):c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>①>② | |
| C. |  常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
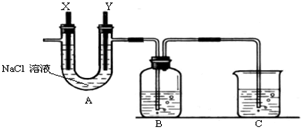
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该物质有很高的熔点、很大的硬度 | |
| B. | 该物质形成的晶体属分子晶体 | |
| C. | 该物质分子中Si60被包裹在C60里面 | |
| D. | C60易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①可推测溶液中一定含大量CO32-、S2-、SO32-、NO3- | |
| B. | 由②可推测溶液中一定含大量NO2- | |
| C. | 由③可推测溶液中一定含大量NO3- | |
| D. | 由实验④难以推测溶液中一定含大量SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

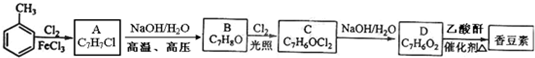
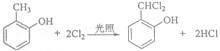 .
.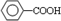 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
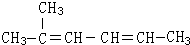 2-甲基-2,4-己二烯.
2-甲基-2,4-己二烯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com