
| A. | Tl+最外层有3个电子 | |
| B. | 氧化性:Tl3+>Ag+>Fe3+ | |
| C. | Tl(OH)3与Al(OH)3相似,也是两性氢氧化物 | |
| D. | 铊位于第五周期 IIIA族 |
分析 A、依据铊(Tl)与铝同主族,最外层电子数为3;
B、氧化还原反应中氧化剂的氧化性大于氧化产物,依据题干反应判断;
C、同主族从上到下,金属元素的最高价氧化物的水化物的碱性增强;
D、根据原子序数推断元素周期表中的位置.
解答 解:A、铊(Tl)与铝同主族,主族元素原子最外层电子相同,则Tl+最外层有2个电子,故A错误;
B、Tl3++2Ag=Tl++2Ag+,且Ag++Fe2+=Ag+Fe3+.氧化剂Tl3+的氧化性大于氧化产物Ag+,氧化剂Ag+的氧化性大于氧化产物Fe3+,所以氧化性顺序为Tl3+>Ag+>Fe3+,故B正确;
C、同主族从上到下,金属元素的最高价氧化物的水化物的碱性增强,则Tl(OH)3的碱性大于Al(OH)3,不是两性氢氧化物,故C错误;
D、原子序数为81,和铝同主族,结合核外电子排布规律写出原子结构示意图判断,铊位于第六周期第ⅢA族,故D错误;
故选B.
点评 本题考查了氧化还原反应的概念应用,规律分析和判断,元素周期表中位置的推断,熟练掌握氧化还原反应的实质和强弱规律,是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA | |
| B. | 20gH218O中含有的质子数为10NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯的水解反应在碱性条件下比在酸性条件下水解更容易 | |
| B. | 油脂的水解可得到甘油,称为皂化反应 | |
| C. | 蛋白质水解的最终产物均为葡萄糖 | |
| D. | 淀粉水解和纤维素水解得到的最终产物相同,它们是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>PH3>AsH3 | B. | 熔点:Li>Na>K>Rb>Cs | ||
| C. | 酸性:HClO4>H2SO4>H2SeO4 | D. | 碱性:KOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 和
和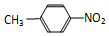 C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl
C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | FeCl2溶液中混有少量的FeCl3:加入足量的铁粉后过滤 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸和pH=5的硫酸溶液等体积混合,pH=4 | |
| B. | 室温下,pH=9的碱性溶液中,存在H+ | |
| C. | 中性溶液中必然有c(H+)=c(OH-)=1×10-7mol•L-1 | |
| D. | 在0.1mol•L-1 HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com