
| A. | Fe2(SO4)3 | B. | 稀硫酸 | C. | AgNO3溶液 | D. | CuSO4 溶液 |
分析 铁和溶液中的溶质反应,导致铁片溶解,溶液质量增加且没有气体生成,说明铁和溶液反应时不是和酸反应,且不能置换出比铁的摩尔质量大的金属单质,据此解答.
解答 解:A.铁与硫酸铁反应生成硫酸亚铁,铁片溶解,溶液质量增加,但没有气体放出,故A正确;
B.铁与稀硫酸反应生成氢气,不符合题意,故B错误;
C.铁和硝酸银发生置换反应,析出银的质量大于铁的质量,导致溶液质量减小,故C错误;
D.铁和硫酸铜发生置换反应,析出铜的质量大于铁的质量,导致溶液质量减小,故D错误;
故选:A.
点评 本题考查铁的化学性质,注意探究与铁反应后溶液质量增减的问题,根据与铁反应前后溶质的相对分子质量的大小来确定溶液质量的增减即可,难度不大.


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
 在常温下,某水溶液M中.
在常温下,某水溶液M中.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molH2O的质量为18g/mol | |
| B. | O2 的摩尔质量为32g | |
| C. | 2mol NaOH 溶于1 L水中配成溶液的浓度为2mol/L | |
| D. | 6.02×1023个CO分子的质量约为28g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
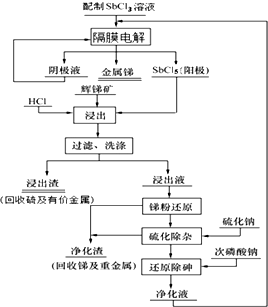 我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图:
我国锑的蕴藏量占世界第一位.某课题组电解三氯化锑水溶液,利用阳极生成的五氯化锑作为浸出剂,对辉锑矿(Sb2S3)进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、H2S、H2Se、H2Te的热稳定性依次减弱 | |
| B. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| C. | CF4、CCl4、CBr4、Cl4的熔、沸点逐渐升高 | |
| D. | 熔点:Al>Mg>Na>K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com