
����Ŀ����.��ҵ����ij����������Cu2O��A12O3��Fe2O3��SiO2)��ȡͭ�Ĺ���������ͼ��

��֪��Cu2O+2H+=Cu+Cu2++H2O��
(1)��Ҫ���������������Ľ����ʣ����Բ��õĴ�ʩ��____________ (��дһ������
�ڿ��������չ�������Dʱ���õ����ֹ������ʵ������������������ƾ��ƣ�����Ҫ�õ���������_____________��
(2)��ҺA����Ԫ�صĴ�����ʽһ����________(�����ӷ��ţ������ɸ����ӵ����ӷ���ʽΪ__________��
(3)�����£���pH��NaA1O2��NaOH������Һ�У���ˮ�������c(OH-)ǰ��Ϊ���ߵ�106������������Һ��pH =________��
��.����Cu2O�������Ĵ����Ͱ뵼����ϣ���ҵ�ϳ������з����Ʊ�Cu2O��
���Ȼ�ԭ�������������£���Һ̬�£�N2H4)��ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O��ͬʱ�ų�N2��
�ڵ�ⷨ���Լ״�ȼ�ϵ��Ϊ��Դ���õ�ⷨ�Ʊ�Cu2O��װ����ͼ��ʾ��

(4)д����Ӧ�ٵĻ�ѧ����ʽ��___________________��
(5)����A�Ļ�ѧʽΪ____________��
(6)�����У������ĵ缫��ӦʽΪ___________________��
(7)���һ��ʱ�����ʹ��������Һ�ָ�ԭ����ɣ�Ӧ�����в���һ������_____________(�ѧʽ����
���𰸡� �����¶Ȼ���������Ũ�Ȼ��������������𰸾����֣� ���� �� ������ Fe2+ Cu+2Fe3+=2Fe2++Cu2+ 10 4Cu(OH)2+N2H4![]() N2��+2Cu2O+6H2O O2
N2��+2Cu2O+6H2O O2 ![]() =Cu2O+H2O H2O
=Cu2O+H2O H2O
��������(1)��Ҫ���������������Ľ����ʣ�������������Է�Ӧ���ʵ�Ӱ���֪���Բ��õĴ�ʩ�������¶Ȼ���������Ũ�Ȼ����������ڿ��������չ�������Dʱ���õ����ֹ������ʵ������������������ƾ��ƣ�����Ҫ�õ��������������������ǡ�(2)������������������ת��Ϊ�Ȼ�����������ͭת��Ϊ�Ȼ�ͭ��ͭ����������������������ͭ������ҺA����Ԫ�صĴ�����ʽһ����Fe2+�����ɸ����ӵ����ӷ���ʽΪCu+2Fe3+=2Fe2++Cu2+��(3)ƫ������ˮ��ٽ�ˮ�ĵ��룬����������ǿ������ˮ�ĵ��룬��![]() �����x��10��(4)���������£���Һ̬�£�N2H4)��ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O��ͬʱ�ų�N2������ԭ���غ�͵��ӵ�ʧ�غ��֪��Ӧ�Ļ�ѧ����ʽΪ4Cu(OH)2+N2H4
�����x��10��(4)���������£���Һ̬�£�N2H4)��ԭ���Ƶ�Cu(OH)2�Ʊ�Cu2O��ͬʱ�ų�N2������ԭ���غ�͵��ӵ�ʧ�غ��֪��Ӧ�Ļ�ѧ����ʽΪ4Cu(OH)2+N2H4![]() N2��+2Cu2O+6H2O��(5)������ͭ�缫��������ʧȥ����ת��Ϊ������ͭ������ͭ�缫�����ĵ缫����������������A�Ļ�ѧʽΪO2��(6)�������Ϸ�����֪�����У������ĵ缫��ӦʽΪ2Cu+2OH�D�D2e����Cu2O+H2O��(7)���ص����������ӷŵ�����������ƣ���������Ũ����������һ��ʱ�����ʹ��������Һ�ָ�ԭ����ɣ�Ӧ�����в���һ������H2O��
N2��+2Cu2O+6H2O��(5)������ͭ�缫��������ʧȥ����ת��Ϊ������ͭ������ͭ�缫�����ĵ缫����������������A�Ļ�ѧʽΪO2��(6)�������Ϸ�����֪�����У������ĵ缫��ӦʽΪ2Cu+2OH�D�D2e����Cu2O+H2O��(7)���ص����������ӷŵ�����������ƣ���������Ũ����������һ��ʱ�����ʹ��������Һ�ָ�ԭ����ɣ�Ӧ�����в���һ������H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�أ�����A��B��C��DΪ����������Ԫ�أ�E��FΪ��������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش����⣮
Aԭ�Ӻ�����ӷ�ռ3����ͬ�ܼ�����ÿ���ܼ����Ų��ĵ�������ͬ |
BԪ��ԭ�ӵĺ���p����������s����������1 |
Cԭ��p����ϳɶԵ���������δ�ɶԵ�����������Aͬ���� |
DԪ�ص������������������IJ�Ϊ4���Ҳ���AԪ����ͬһ���� |
E�ǵ�����Ԫ�� |
F�ǵ�29��Ԫ�� |
��1��A�Ļ�̬ԭ����������ߵĵ��ӣ���������ڿռ��� ������ԭ�ӹ���� �Ρ�
��2��E2+�Ļ�̬��������Ų�ʽΪ ��
��3��A��B��C����Ԫ�ص�����⻯����۵��ɵ͵��ߵ�˳���� ����B��C����Ԫ����ɵķ�����AC2��Ϊ�ȵ�����ķ��ӵĽṹʽΪ ��(�û�ѧʽ��ʾ)
��4��BD3 ����ԭ�ӵ��ӻ���ʽΪ ������ӿռ乹��Ϊ ��
��5���þ����x�������䷨��F�IJⶨ�õ����½����F�ľ���Ϊ�����������ܶѻ�(��ͼ)����֪�þ�����ܶ�Ϊ9.00g/cm3�������и�ԭ�ӵ���λ��Ϊ ��F��ԭ�Ӱ뾶�� cm��(�����ӵ�����ΪNA��Ҫ����ʽ����)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.�ع��͵�ˮ�ⷴӦ����ȡ����Ӧ
B.��NaOH��Һ���Գ�ȥ���������е�����
C.���ǡ���֬�͵����ʶ����ڸ߷��ӻ�����
D.���ͼױ���������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʣ���NaOH��Һ����Һ������BaCO3���壬������KHSO4����Fe(OH)3���壬
��ͭ����CO2����CH3COOH��
��1���������������ڻ�������_______������ţ���ͬ�������ڷǵ���ʵ���_______��
��2��������������ͨ�磬�۲쵽����������������__________�����ϴ��������ܵ������_______��
��3��д����������ˮ��Һ��Ӧ�����ӷ���ʽ��_______________________��
��4������������ˮ��Һ�м�����������������Ӧ�����ӷ���ʽΪ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
�㶹���ǹ㷺������ֲ���е�һ����廯��������й����ԣ��еĻ����п������������ã������������㾫�Լ��������û�ױƷ�������ȡ����ĺ��Ľṹ�Ƿ�������A�������ʽΪC9H6O2���÷�������A�����в���ת��ΪE��ˮ���ᡣ

��ʾ��CH3CH��CHCH2CH3![]() CH3COOH��CH3CH2COOH
CH3COOH��CH3CH2COOH
��ش��������⣺
��1��������A�й���������Ϊ_____________��������E�Ļ�ѧ������________��
��2��B��C�ķ�Ӧ����ʽΪ______���÷�Ӧ����Ϊ_______���÷�Ӧ�����Ŀ����_________________��
��3��������D�ж���ͬ���칹�壬����һ��ͬ���칹���DZ��Ķ�ȡ�����ˮ������ɵIJ���֮һ�ܷ���������Ӧ������ͬ���칹�干��________�֣�д�����к˴Ź���������5�ַ壬�����ź�ǿ��֮��Ϊ1��1��2��2��2��ͬ���칹��Ľṹ��ʽ__________��
��4����֪R��CH��CH2![]() R��CH2��CH2��Br������ƺ���������
R��CH2��CH2��Br������ƺ��������� �ϳ�
�ϳ� ���÷�Ӧ����ͼ��ʾ����ע����Ӧ��������______
���÷�Ӧ����ͼ��ʾ����ע����Ӧ��������______
�������Ҵ��ϳ���ϩ�ķ�Ӧ����ͼ�ɱ�ʾΪ
CH3CH2OH![]() CH2��CH2
CH2��CH2![]()
![]() CH2��CH2
CH2��CH2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йذ����ӵ�����NA˵������������ ��
A��22 g 2H218O�к��е�������Ϊ10NA
B�����58.5 g���ڵ�NaCl���ܲ���11.2 L��������״������23.0 g������
C��1.00 mol NaCl�У�����Na+��������������Ϊ10NA
D��1 mol Na������O2��Ӧ������Na2O��Na2O2�Ļ�����ʧȥNA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����һԪȩ����������Ӧʱ����21.6�˵����������������ĸ�ȩ��ȫȼ�գ����ɶ�����̼���Ϊ13.44L������£������ȩ�ǣ�������
A. ��ȩ B. 3������ȩ C. ��ȩ D. ��ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ˮ��Һ���ܴ���������ǣ� ��
A. Na+��HCO3-��SO32-��OH- B. Al3+��H+��SiO32-��I-
C. Fe2+��K+��NO3-��SO42- D. Fe3+��NH4+��ClO-��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(E)���������Ƹ���ԭ���Ը�Ѫѹ��ҩ���ϳ�·�����£�
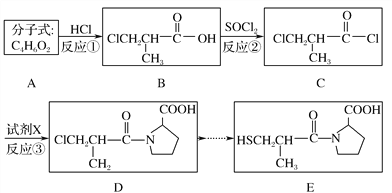
(1)A��ϵͳ����Ϊ____________��B�й����ŵ�������________��B��C�ķ�Ӧ������________��
(2)C��Dת������һ������HCl�����Լ�X�ķ���ʽΪ________��
(3)D��NaOH����Һ�з�����ȥ��Ӧ�����ữ��IJ���Y�ж���ͬ���칹�壬д��ͬʱ������������������Y��ͬ���칹��Ľṹ��ʽ��_______________��______________________________��
a�����������ʾ�����к��б��������������ĸ�ȡ�����Ҳ�����
b���˴Ź���������ʾ��������6�ֲ�ͬ��������ԭ��
c������FeCl3��Һ������ɫ��Ӧ
(4)B������������Һ�е�ˮ������ữ����Է����ۺϷ�Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ��_______________________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com