
| A. | 碱性:KOH>NaOH | B. | 金属性:Na>Al | C. | 稳定性:HF>CH4 | D. | 酸性:HClO<HClO4 |
分析 A.金属性越强,对应碱的碱性越强;
B.同周期从左向右金属性减弱;
C.非金属性越强,对应氢化物越稳定;
D.非金属性越强,对应最高价含氧酸的酸性越强,而同种元素的含氧酸中非羟基O原子个数越多酸性越强.
解答 解:A.金属性K>Na,则碱性:KOH>NaOH,故A正确;
B.同周期从左向右金属性减弱,则金属性:Na>Al,故B正确;
C.非金属性F>C,则稳定性:HF>CH4,故C正确;
D.HClO不是最高价含氧酸,酸性:HClO<HClO4,不能用元素周期律解释,故D错误;
故选D.
点评 本题考查元素周期律和周期表,为高频考点,把握元素在周期表的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NO2、NO、O2的物质的量之比是2:1:1 | |
| B. | 单位时间内生成1mol O2的同时生成2mol NO2 | |
| C. | 混合气体的颜色不再改变的状态 | |
| D. | 混合气体的平均相对分子质量不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | 全部都可以 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的有机物有三种,它们互为同系物 | |
| B. | 淀粉和纤维素的化学式相同,化学性质相似 | |
| C. | 乙酸乙酯在过量氢氧化钠溶液中加热,生成乙酸和乙醇 | |
| D. | 溶解度:甘油>1-丁醇>甲酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
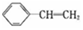 .有关该物质的下列说法正确的是( )
.有关该物质的下列说法正确的是( )| A. | 该物质在一定条件下和氢气完全加成,加成产物的一溴取代物有6种 | |
| B. | 该物质能使溴水和酸性高锰酸钾溶液褪色,褪色原理完全相同 | |
| C. | 苯乙烯分子的所有原子不可能在同一平面上 | |
| D. | 除去 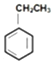 中的苯乙烯可以通入等量氢气反应 中的苯乙烯可以通入等量氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极反应为Li-e-═Li+ | |
| B. | 放电时,正极发生氧化反应 | |
| C. | 硫酸、羧酸及醇类物质都可以用作该锂电池的电解质 | |
| D. | 充电时,阳极只有Fe参与放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
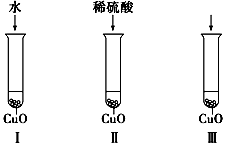 氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.
氧化铜是一种黑色固体,可溶于稀硫酸.某同学想知道是稀硫酸的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解.请你和他一起通过如图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com