
| A. | $\frac{n(A-N-2)}{A}$ mol | B. | $\frac{n(A-N+8)}{A+16}$mol | C. | $\frac{n(A-N+8)}{A+8}$mol | D. | $\frac{n(A-N+2)}{A}$mol |
分析 该离子的相对原子质量在数值上等于其质量数,根据n=$\frac{m}{M}$计算ng R2+的物质的量,核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,离子核外电子数为A-N-2,进而计算电子物质的量.
解答 解:核内中子数为N的R2+离子,质量数为A,所以质子数为A-N,离子核外电子数为A-N-2,ng R2+的物质的量为$\frac{ng}{Ag/mol}$=$\frac{n}{A}$mol,含有电子物质的量为$\frac{n}{A}$mol×(A-N-2)=$\frac{n(A-N-2)}{A}$mol,
故选:A.
点评 本题考查物质的量计算以及质子数、中子数、质量数之间的关系,难度不大,有利于基础知识的巩固和提高学生的计算能力.


科目:高中化学 来源: 题型:解答题
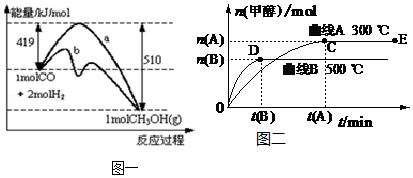
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ②③④ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AX | B. | BX | C. | AY | D. | BY |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 实验方法 |
| 证明地瓜粉中有淀粉 | B |
| 检验酒精中是否含有水 | C |
| 证明NaOH溶液呈碱性 | D |
| 除去FeCl2溶液中少量的FeCl3 | A |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
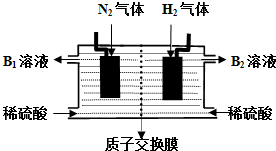
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有N | B. | 只有S | C. | 只有C | D. | N和S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com