
【题目】海水中的成盐元素除了氯之外,还有溴和碘。
(1)工业上可用Cl2和NH4Cl溶液反应制取NCl3(NCl3既可用于漂白,又可用于柠檬等水果的熏蒸处理)。当用干燥洁净的玻璃棒蘸取NCl3滴到干燥的红色石蕊试纸上,试纸不褪色;若取NCl3滴入50-60oC热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,则试纸先变蓝后褪色。写出对应该现象的化学方程式:____________________________________________________。
(2)①碘酸钾与碘化钾在酸性条件下发生如下反应,配平该反应的化学方程式:______KIO3+ ______KI + H2SO4 = ______K2SO4+_____I2+ ______
②上述反应生成的I2可用四氯化碳检验,现象为________________________________________。
(3)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
粒子 | I2 | Br2 | IO3- |
物质的量物的/mol | 0.5 | 1.3 | x |
则x= ______;原溶液中NaI的物质的量为______mol。
【答案】NCl3+3H2O![]() 3HClO+NH3 KIO3+5KI +3H2SO4 =3K2SO4+3I2+3H2O 溶液分层,下层显紫(红)色 2 3
3HClO+NH3 KIO3+5KI +3H2SO4 =3K2SO4+3I2+3H2O 溶液分层,下层显紫(红)色 2 3
【解析】
(1)当装置D的锥形瓶内有较多黄色油状液体出现时,产生的是NCl3,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60℃的热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,考虑到NCl3在热水中易水解,根据实验现象判断水解产物,据此分析解释原因;(3)根据氧化还原反应中得失电子数相等。
(1)当装置D的锥形瓶内有较多黄色油状液体出现时,产生的是NCl3,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60℃的热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,考虑到NCl3在热水中易水解,根据实验现象,可以判断NCl3水解产生NH3H2O,同时产生HClO,使试纸后来褪色,故答案为:在热水中发生的反应为NCl3+3H2O![]() 3HClO+NH3↑,NCl3本身无漂白性,但在热水中会水解生成NH3H2O使红色的石蕊试纸变蓝,而生成的HClO又使其褪色;(2)①碘酸钾中碘的化合价从+5价降低到0价,得到5个电子。碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,所以方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;②上述反应生成的I2可用四氯化碳检验,现象为溶液分层,下层显紫(红)色;(3)根据氧化还原反应中得失电子数相等,可得5×2.6mol=2×0.5mol+6×n(IO3),则n (IO3)=2mol,根据元素守恒,原溶液中n(NaI)=0.5mol×2+2mol=3mol。
3HClO+NH3↑,NCl3本身无漂白性,但在热水中会水解生成NH3H2O使红色的石蕊试纸变蓝,而生成的HClO又使其褪色;(2)①碘酸钾中碘的化合价从+5价降低到0价,得到5个电子。碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,所以方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;②上述反应生成的I2可用四氯化碳检验,现象为溶液分层,下层显紫(红)色;(3)根据氧化还原反应中得失电子数相等,可得5×2.6mol=2×0.5mol+6×n(IO3),则n (IO3)=2mol,根据元素守恒,原溶液中n(NaI)=0.5mol×2+2mol=3mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列分类不正确的是
A.酸: HNO3、K2SO4、H2CO3B.碱:Cu(OH)2、NaOH、Ca(OH)2
C.盐:AgCl、BaSO4、Mg(NO3)2D.氧化物:FeO、SO2、CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 键角越大,该分子越稳定
B. 共价键的键能越大,共价键越牢固,含有该键的分子越稳定
C. CH4、CCl4中键长相等,键角不同
D. C===C键的键能是C—C键的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物PA66的合成路线如下:

已知:
(1)A属于芳香化合物,其结构简式是____________。
(2)①的化学方程式是____________。
(3)C中所含官能团的名称是____________。
(4)②的反应条件是____________。
(5)④的化学方程式是____________。
(6)![]() 有多种同分异构体,符合下列条件的有______种,写出其中任意一种同分异构体的结构简式:_____
有多种同分异构体,符合下列条件的有______种,写出其中任意一种同分异构体的结构简式:_____
i.为链状化合物且无支链;ii.为反式结构;III.能发生银镜反应。
(7)已知:RCH=CH2![]() RCH2CH2COOCH3
RCH2CH2COOCH3
有机物C可由2-丁烯经4步反应合成,请结合题中信息补充完整下列合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。____
CH=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
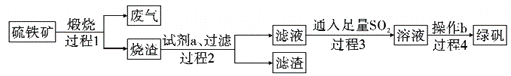
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜——稀硫酸原电池的装置如图所示,下列叙述错误的是( )

A. 电流从锌片经导线流向铜片 B. 锌是负极,其质量逐渐减小
C. 氢离子在铜表面被还原,产生气泡 D. 依据该实验现象可判断锌比铜活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液.实验室一般先称取一定质量的KMnO4晶体,配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对配制的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42﹣+2MnO4﹣+16H+═10CO2↑+2Mn2++8H2O
以下是标定KMnO4溶液的实验步骤:
步骤一:先配制浓度约为0.10molL﹣1的高锰酸钾溶液500mL.
步骤二:取0.02molL﹣1 的Na2C2O420.00mL放入锥形瓶中,并加稀硫酸酸化,用步骤一所配高锰酸钾溶液进行滴定.三次平行实验的数据记录在表中:
平行实验编号 | Na2C2O4溶液 | 滴定管起始读数(mL) | 滴定管滴定终点读数(mL) |
① | 20.00 | 0.00 | 21.18 |
② | 20.00 | 1.02 | 21.00 |
③ | 20.00 | 1.18 | 21.20 |
试回答下列问题:
(1)步骤一中要用到的主要玻璃仪器是除烧杯、玻璃棒外还需 .
(2)步骤二中滴定操作选用滴定管(填“酸式”或“碱式”)滴定终点的判断方法:
(3)下来滴定操作会导致测量结果偏高的是
A.滴定管滴定前有气泡,滴定后气泡消失
B.锥形瓶洗涤后没有干燥
C.滴定终点时,读数时俯视
D.滴定时锥形瓶中有液体溅出
E.一滴高锰酸钾溶液附在锥形瓶壁上未冲下
(4)从实验所得数据计算,KMnO4溶液的浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.2mol/LH2C2O4溶液中滴加0.2mol/LKOH溶液,水电离出氢离子浓度c(H+)与加入氢氧化钾溶液的体积的变化如下图,已知常温下,H2C2O4的电离常数为:K1=5.0×10-2,K2=5.4×10-5,根据图示判断,下列说法不正确的是( )

A. c点的溶液显碱性
B. a点时,加入KOH溶液的体积V1=10mL
C. b点时,溶液中各粒子浓度的大小顺序为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
D. 当V(KOH)=15mL时,溶液中存在以下关系:2c(K+)=3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com