
X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m﹣n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是()
A. X与Y形成的两种化合物中阴、阳离子的个数比均为1:2
B. Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低
C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D. Y分别与Z、W、R以两种元素组成的常见化合物有5种
考点: 原子结构与元素周期律的关系.
专题: 元素周期律与元素周期表专题.
分析: X、Y、Z、W、R均为短周期元素,它们都不是稀有气体元素,X元素原子半径最大,则X为Na元素;Y 元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m﹣n,则m+n=8,故Y只能有2个电子层,则n=2,故m=8﹣2=6,可推知Y为O元素;Z元素M层电子数=6﹣2=4,则Z为Si元素;W元素与Z元素同主族,可推知W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,可知R原子核外电子数为16,则R为S元素,据此解答
解答: 解: X、Y、Z、W、R均为短周期元素,它们都不是稀有气体元素,X元素原子半径最大,则X为Na元素;Y 元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m﹣n,则m+n=8,故Y只能有2个电子层,则n=2,故m=8﹣2=6,可推知Y为O元素;Z元素M层电子数=6﹣2=4,则Z为Si元素;W元素与Z元素同主族,可推知W为C元素;R元素原子与Y元素原子的核外电子数之比为2:1,可知R原子核外电子数为16,则R为S元素.
A.氧化钠与过氧化钠中阴、阳离子的个数之比均为1:2,故A正确;
B.非金属性O>S,故氢化物稳定性O>S,水分子之间存在氢键,其熔沸点高于硫化氢,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S>C>Si,所以酸性强弱顺序为:硫酸>碳酸>硅酸,故C正确;
D.氧元素分别与硅、碳、硫元素组成的常见化合物有:二氧化硅、一氧化碳、二氧化碳、二氧化硫和三氧化硫五种,故D正确,
故选B.
点评: 本题考查结构性质位置关系应用,正确推断元素是解题的关键,注意对基础知识的理解掌握,难度不大,注意元素周期律的灵活运用,知道氢键对物质物理性质的影响.


科目:高中化学 来源: 题型:
根据阿伏加德罗理论:在相同温度和压强下,相同体积的任何气体都含有相同数目的粒子.在一定温度和压强下,1体积的A2气体和3体积的B2气体合成2体积的C气体,则C气体的化学式为( )
|
| A. | AB | B. | AB3 | C. | A3B | D. | A2B3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物发生的反应属于加成反应的是()
A. 乙烯使KMnO4溶液褪色
B. 乙烯使溴的四氯化碳溶液褪色
C. 甲烷和氯气混合,见光
D. 用乙醇、乙酸与浓H2SO4混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)⇌NH3(g)+HI(g);
②2HI(g)⇌H2(g)+I2(g)
达到平衡时,c(H2)=0.25mol/L,c(HI)=5mol/L,
则此温度下反应①的平衡常数(单位:mol2•L﹣2)为()
A. 25 B. 0.025 C. 30.25 D. 27.5
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是一个化学过程的示意图
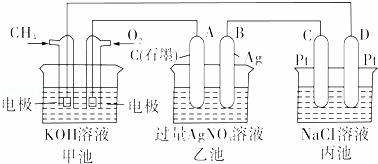
回答下列问题:(1)甲池是 极A的名称是
(2)甲装置中通入CH4的电极反应式为
乙装置中B(Ag)的电极反应式为 ,
丙装置中D极的产物是 和 (写化学式),
(3)一段时间,当丙池中产生112mL(标准状况下)气体,若要使丙池恢复电解前的状态,应向丙池中 (写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
美丽中国,节约为荣.“开源节流”是应对能源危机的重要举措.请回答下列问题:
(1)下列做法不利于能源“开源节流”的是b(填序号).
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气,以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源,减少煤、石油等化石燃料的使用
d.减少资源消耗,增加资源的重复使用,注重资源的循环再生
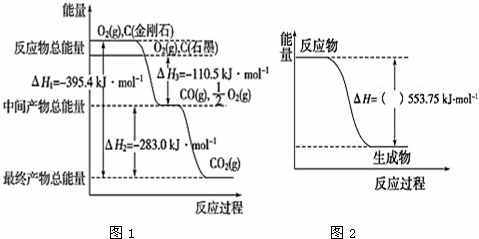
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应放出的热量如图1所示:
①在通常状况下,石墨(填“金刚石”或“石墨”)更稳定,石墨的燃烧热△H= .
②又已知:2H2(g)+O2(g)═2H2O(l)△H2=﹣571.6kJ•mol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=﹣2599.2kJ•mol﹣1根据盖斯定律及以上信息,写出C(石墨)与H2(g)反应生成1molC2H2(g)的热化学方程式: .
(3)丙烷(C3H8)是一种优良的气体燃料.试回答下列问题:
①如图2是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图(图中括号内“+”或“﹣”未标注),写出表示丙烷燃烧热的热化学方程式: .
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔,1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量,若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值.下列叙述正确的是()
A. 1mol•L﹣1NaCl溶液含有NA个Na+
B. 任意条件下,16g O3所含的原子数为NA
C. 由CH4和C2H6组成的混合物中共有NA个分子,其中的氢原子数为5NA
D. 标准状况下,22.4 L SO3所含的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶无色溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、I﹣、Cl﹣、NO3﹣、CO32﹣、SO42﹣,取该溶液进行以下实验:
(1)该溶液可使pH试纸呈现红色;
(2)取溶液少量加新制氯水及CCl4振荡,可见CCl4层呈现紫色;
(3)取溶液少量加氯化钡溶液,有白色沉淀生成,加入HNO3后沉淀不溶解;
(4)取实验(3)之上层清液,加入硝酸银溶液有白色沉淀,加入HNO3后沉淀不溶解;
(5)取原溶液少量加入NaOH溶液呈碱性,在此过程中有白色沉淀生成,而后又逐渐消失,将此溶液加热,有无色气体放出,该气体能使润湿的红色石蕊试纸变蓝.根据上述实验事实,溶液中肯定存在的离子有 ,肯定不存在的离子有 ,不能确定是否存在的离子有 .
查看答案和解析>>
科目:高中化学 来源: 题型:
将铝投入到一定量的NaOH溶液中,充分反应后,有2mol的电子发生了转移.则参加反应的铝的物质的量为( )
|
| A. |
| B. | 1mol | C. | 2mol | D. |
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com