
【题目】(1)假设元素周期表可以发展到第八周期,而且电子仍按照构造原理填入能级,第八周期应为_____种元素。
(2)已知N-N、N=N和N≡N键能之比为1.00:2.17:4.90,而C-C、C=C、C≡C键能之比为1.00:1.77:2.34.如何用这些数据理解氮分子不容易发生加成反应而乙炔容易发生加成反应?___
(3)下图是两种具有相同分子式的有机物——邻羟基苯甲酸和对羟基苯甲酸的结构简式。已知它的沸点相差很大,其中对羟基苯甲酸沸点较高,如何从氢键的角度来解释?_______
邻羟基苯甲酸 对羟基苯甲酸
对羟基苯甲酸
(4)离子晶体如食盐,很脆,经不起锤击;原子晶体如石英,同样很脆,也经不起锤击。然而食盐和石英的摩氏硬度却相差极大,应如何解释?____________________________________
(5)如图依次是金属钠、金属锌、碘、金刚石晶胞的示意图,

i:上图的碘晶体中碘分子的排列有____种不同取向,晶胞平均含_______个原子。
ii:金属锌晶胞参数依次为:a=266.49 pm,b=266.49 pm,c=494.68 pm,α=90°,β=90°,γ=120°,则该晶胞的底面积为 ___________cm2.。(只列式不计算)。
【答案】50 前者每多出两条键其键能大于原来的三倍,要破坏需要吸收的能量更多;后者每增加两条化学键其键能增加量却小于原来的3倍,要破坏需要吸收的能量更少。 邻羟基苯甲酸可以形成分子内氢键,使熔沸点偏低,对羟基苯甲酸可以形成分子间氢键,使熔沸点偏高,则对羟基苯甲酸的沸点比邻羟基苯甲酸的高。 离子晶体和原子晶体的晶体类型不同,使它们的性质存在很大差异 2 8 266.49 ×sin60°×266.49 ×10—14
【解析】
(1)根据元素周期表中前七个周期中含有的元素种类数分别为2、8、8、18、18、32、32分析;
观察每一周期的元素种类可知,第一周期遵循2×12,第二、三周期遵循2×22,第四、五周期遵循2×32,第六、七周期遵循2×42;
据此可以得出第八周期的元素种类数为2×52,据此得出答案;
(2)根据键能数据比较共价键的强弱以及反应活泼性,氮气分子很稳定是因为氮分子内存在氮氮三键;
(3)邻羟基苯甲酸可以形成分子内氢键,使熔沸点偏低;而对羟基苯甲酸可以形成分子间氢键,使熔沸点偏高;
(4)在离子晶体中,构成晶体的粒子是阴、阳离子,阴、阳离子间通过离子键相互作用;而在原子晶体中,构成晶体的粒子是原子,原子间以较强的共价键相互作用,而且形成空间网状结构;
(5)i碘为分子晶体,晶胞中占据顶点和面心,以此分析;
ii依据锌的晶胞示意图及锌晶胞的空间形状,求算晶胞的底面积。
(1)通过分析每一周期的元素种类可知,第一周期遵循2×12,第二、三周期遵循2×22,第四、五周期遵循2×32,第六、七周期遵循2×42;据此可以得出第八周期的元素种类数为2×52,即50种;
本题答案为:50;
(2)键能数据表明,N≡N键能大于N—N键能的三倍,而C≡C键能却小于C—C键能的三倍,说明乙烯和乙炔中的π键不牢固,故易发生加成反应,而氮分子中N≡N非常牢固,所以氮分子不易发生加成反应;
本题答案为:前者每多出两条键其键能大于原来的三倍,要破坏需要吸收的能量更多;后者每增加两条化学键其键能增加量却小于原来的3倍,要破坏需要吸收的能量更少;
(3)邻羟基苯甲酸可以形成分子内氢键,使熔沸点偏低;而对羟基苯甲酸可以形成分子间氢键,使熔沸点偏高,故对羟基苯甲酸的沸点比邻羟基苯甲酸的高,
本题答案为:邻羟基苯甲酸可以形成分子内氢键,使熔沸点偏低;而对羟基苯甲酸可以形成分子间氢键,使熔沸点偏高,则对羟基苯甲酸的沸点比邻羟基苯甲酸的高;
(4)在离子晶体中,构成晶体的粒子是阴、阳离子,阴、阳离子间通过离子键相互作用;而在原子晶体中,构成晶体的粒子是原子,原子间以较强的共价键相互作用,而目形成空间网状结构。因此,属于离子晶体的食盐的摩氏硬度和属于原子晶体的石英的摩氏硬度存在很大差异;
本题答案为:离子晶体和原子晶体的晶体类型不同,使它们的性质存在很大差异;
(5)i碘为分子晶体,晶胞中占据顶点和面心,碘分子的排列有2种不同的取向,用均摊法可知平均每个晶胞中有4个碘分子,即有8个碘原子;本
题答案为:2,8;
ii锌为六方锥晶体,其底面积为菱形面积,故底面积为:a![]() sin60°
sin60°![]() b=266.49 ×sin60°×266.49 ×10—14cm2,
b=266.49 ×sin60°×266.49 ×10—14cm2,
本题答案为:266.49 ×sin60°×266.49 ×10—14。


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
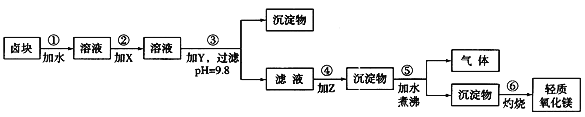
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6﹡ |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
表2 原料价格表
物质 | 价格/(元·吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(1)在步骤②中加入的试剂X,最佳的选择是____________,其作用是_________________;
(2)在步骤③中加入的试剂应是_______________________;之所以要控制pH=9.8,其目的是___________________________________________________________。
(3)在步骤④中加入的试剂Z应是________________;/p>
(4)在步骤⑤中发生反应的化学方程式是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.86 | 1.10 | 0.99 | 1.52 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)⑥的单质在空气中加热,生成物的电子式为_______________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___________。
(3)比较①和⑦的氢化物的稳定性(用化学式表示)_______________________________。
(4)写出实验室制备⑤的单质的离子方程式:________________________________。
(5)写出⑧的单质跟③的最高价氧化物的水化物的溶液反应的离子方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】老鼠能在含饱和多氟碳化物的溶液内部获得氧气,像鱼儿一样在水中游动,另有实验表示,把狗身上的70%的血液,换成由25%的多氟碳化物和75%的水混合成的乳液后仍可存活,科学家预测多氟碳化物可能成为血液的替代品.全氟丙烷(C3F8)是一种常见的多氟碳化物,下列对该物质的叙述中正确的是
A. 全氟丙烷的电子式为 B. 原子半径C比F的小
B. 原子半径C比F的小
C. 全氟丙烷分子中的化学键只有共价键 D. 全氟丙烷分子中碳链成直线型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消去反应是有机合成中引入不饱和键的常见途径,大部分卤代烃和醇都有这一性质。
(1)一定条件下部分卤代烃脱卤化氢或醇脱水后,相应产物及其产率如下表:
卤代烃或醇 | 相应产物及其产率 |
|
81% 19% |
|
80% 20% |
|
80% 20% |
|
90% 10% |
分析表中数据,得到卤代烃和醇发生消去反应时脱氢位置倾向的主要结论是_________。
(2)列举一个不能发生消去反应的醇,写出结构简式:_______________________________。
(3)已知在浓硫酸的作用下脱水,生成物有顺-2-戊烯(占25%)和反-2-戊烯(占75%)两种。写出2-戊烯的顺式结构:_______________________________。
(4)以下是由2-溴戊烷合成炔烃C的反应流程:
![]()
A的结构简式为_________________,C的结构简式为___________________,流程中的反应属于消去反应的是___________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. NH4+中质子数和电子数相等 B. 乙醇比乙二醇的沸点低
C. 乙炔与苯的实验式均为 CH D. 过氧化钠与过氧化氢中均含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中亚硫酸表现的性质,其中一种与另外三种不同的是( )
A.能使酸性高锰酸钾褪色B.在空气中易被氧化变质
C.能使溴水褪色D.在溶液中加入氢氧化钡溶液产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: ________________________________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有__________________________________________。
②如何证明晶体已洗净?_________________________________________。
(4)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种固态物质熔化(或升华)时,克服的微粒间相互作用力属于同种类型的是( )
A.碘和碘化钠B.金刚石和大理石
C.冰醋酸和硫磺D.干冰和二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com