
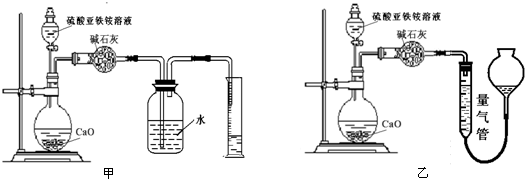
分析 (1)由实验一和实验二中的现象分析;
(2)NO、NO2等体积通入浓硫酸中反应生成NOHSO4,根据原子守恒书写方程式;
(3)NO2能溶于浓硫酸,NO2与无水氯化钙不反应;Pb(NO3)2加热分解生成NO2和PbO、O2.
解答 解:(1)实验一:将制得的纯净的NO2通入浓硫酸中,溶液变成棕黄色,加热浓硫酸,气体逸出,溶液颜色褪去,说明NO2溶于浓硫酸但不与浓硫酸反应;
实验二:将制得的纯净的NO通过浓硫酸后用排水集气法收集到足量无色气体,通入氧气后气体变成红棕色,说明NO不溶于浓硫酸也不与浓硫酸反应;
故答案为:NO2溶于浓硫酸但不与浓硫酸反应,NO不溶于浓硫酸也不与浓硫酸反应;
(2)NO、NO2等体积通入浓硫酸中反应生成NOHSO4,由原子守恒书写出方程式为NO+NO2+2H2SO4=2NOHSO4+H2O;
故答案为:NO+NO2+2H2SO4=2NOHSO4+H2O;
(3)能溶于浓硫酸,所以不能用浓硫酸干燥NO2,NO2与无水氯化钙不反应,所以可以用无水氯化钙干燥NO2;Pb(NO3)2加热分解生成NO2和PbO、O2,反应方程式为:2Pb(NO3)2$\frac{\underline{\;加热\;}}{\;}$2PbO+4NO2↑+O2↑;
故答案为:无水氯化钙;2Pb(NO3)2$\frac{\underline{\;加热\;}}{\;}$2PbO+4NO2↑+O2↑.
点评 本题考查了氮的氧化物的性质、干燥剂的选择、化学方程式等,题目难度中等,侧重于考查学生的分析能力和对题中信息的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 17g羟基与17g NH3所含电子数均为10NA | |
| B. | lmolCl2溶于水转移电子数为NA | |
| C. | 1L0.1mol•L-1 NH4 HC03溶液中所含NH4+数为0.1NA | |
| D. | 标准状况下,11.2LN2和02混合气体中所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
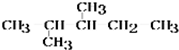
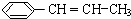 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式: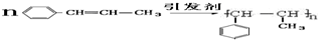
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
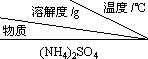 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
. .
. ,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
,该化合物是由极性(填“极性”或“非极性”)共价键形成的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 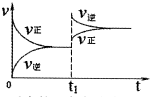 反应的正方向放热(t1时升温) | |
| B. | 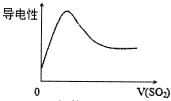 SO2气体通入氯水中 | |
| C. | 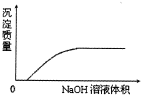 NaOH溶液滴加Ca(HCO3)2溶液中 | |
| D. | 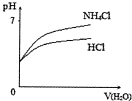 将PH相同的NH4Cl溶液和稀盐酸稀释时PH的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
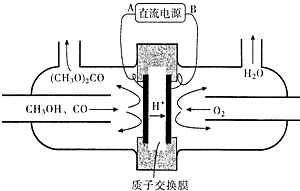
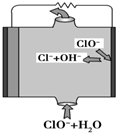 镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )| A. | 放电过程中OH-移向正极 | |
| B. | 电池的总反应式为Mg+ClO-+H2O═Mg(OH)2+Cl- | |
| C. | 镁燃料电池中镁均为负极,发生氧化反应 | |
| D. | 镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
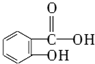 ,俗名水杨酸.
,俗名水杨酸. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com