
【题目】A是化合物,B是金属单质,它们之间相互反应以及生成物之间的转化关系如图所示: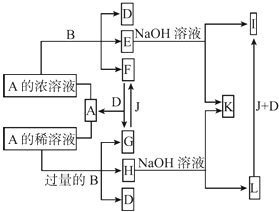
(1)金属B在元素周期表中的位置是 , B和A的浓溶液反应的条件是 . 写出少量B与A的稀溶液反应的离子方程式: .
(2)常温下0.1 mol/L E的水溶液中各离子浓度大小关系为 .
(3)L转化为I的现象是 . 写出有关的化学方程式: .
(4)如何检测H溶液中阳离子的存在,写出实验操作方法、现象、结论: .
(5)已知25℃时Fe(OH)3的Ksp=3.5×10﹣39 , 现将4.0×10﹣8 mol/L E溶液与2.0×10﹣8 mol/L NaOH溶液等体积混合(忽略溶液混合时体积的变化),通过列式计算说明是否有沉淀产生: .
【答案】
(1)第四周期Ⅷ族;加热;Fe+4H++NO3﹣=Fe2++NO↑+2H2O
(2)c(NO ![]() )>c(Fe3+)>c(OH﹣)>c(H+)
)>c(Fe3+)>c(OH﹣)>c(H+)
(3)白色沉淀变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+
(5)混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成
【解析】解:E、H与氢氧化钠溶液反应分别生成I、L,I和L又能和J、D发生转化,说明金属B为变价金属,B可能为Fe.E、H均为B盐溶液,A能与B反应生成多种物质,说明A为酸,A与Fe反应时与酸的浓度有关,则A可能是硫酸或硝酸,根据G+J→F可以判断A是硝酸不是硫酸(氢气与二氧化硫无法转化),故酸A为HNO3 , B为Fe,结合转化关系,可推知F为NO2 , A为HNO3 , E为Fe(NO3)3、D为H2O、I为Fe(OH)3、G为NO、F为O2、H为Fe(NO3)2 , L为Fe(OH)2 , K为NaNO3 . (1)金属B为Fe,在元素周期表中的位置是:第四周期Ⅷ族,Fe和浓硝酸反应的条件是:加热,少量Fe与稀硝酸反应的离子方程式:Fe+4H++NO3﹣=Fe2++NO↑+2H2O,所以答案是:第四周期Ⅷ族;加热;Fe+4H++NO3﹣=Fe2++NO↑+2H2O;(2)常温下0.1 mol/L Fe(NO3)3的水溶液中Fe3+水解,溶液呈酸性,各离子浓度大小关系为:,
所以答案是:c(NO3﹣)>c(Fe3+)>c(OH﹣)>c(H+),
所以答案是:c(NO3﹣)>c(Fe3+)>c(OH﹣)>c(H+);(3)L转化成I的现象是:白色沉淀变成灰绿色,最终变成红褐色,有关的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3 ,
所以答案是:白色沉淀变成灰绿色,最终变成红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3;(4)检测Fe(NO3)2溶液中阳离子的存在:取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+ ,
所以答案是:取少量H溶液于试管中,先加入几滴KSN溶液,无明显现象,再加几滴新制的氯水,溶液变为血红色,证明溶液中含有Fe2+;(5)等体积混合的瞬间,体积加倍浓度减半,混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成,
所以答案是:混合后溶液中的c(Fe3+)=2×10﹣8mol/L,c(OH﹣)=1×10﹣8mol/L,则Qc=c(Fe3+)×c3(OH﹣)=2.0×10﹣32>Ksp , 有沉淀生成.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子,可能大量共存于无色溶液中的是 ( )
A. Na+、H+、CO32-、NO3- B. Fe3+、Mg2+、Cu2+、Cl-
C. Na+、OH-、HCO3-、Cl- D. Ba2+、Cl-、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】难挥发性二硫化钽(TaS2)可采用如下装置提纯.将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中.反应如下:TaS2(s)+2I2(g)TaI4(g)+S2(g)下列说法正确的是( ) ![]()
A.在不同温度区域,TaI4的量保持不变
B.在提纯过程中,I2的量不断减少
C.在提纯过程中,I2的作用是将TaS2从高温区转移到低温区
D.该反应的平衡常数与TaI4和S2的浓度乘积成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Fe、FeO和Fe2O3的混合物放入2mol/L的HNO3溶液25mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
A.40mL
B.45mL
C.50mL
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~M为中学化学的常见物质,它们之间的转化关系如图所示,部分生成物和反应条件省略.已知C、D是由元素X、Y、Z中的两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.请回答下列问题: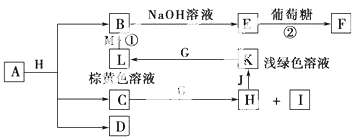
(1)写出A的化学式: .
(2)比较Y与Z的原子半径大小:>(填元素符号).
(3)检验L溶液中金属阳离子的方法是 .
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体.请写出该反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,下列说法中错误的是
A. 1 mol H2含有的原子数为2NA
B. NA个水分子中含有氢原子的物质的量为2 mol
C. 1 mol O2中含有的分子数为2NA
D. 0.25 mol H2SO4含有NA个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。以下是氯元素形成物质的二维图的部分信息。
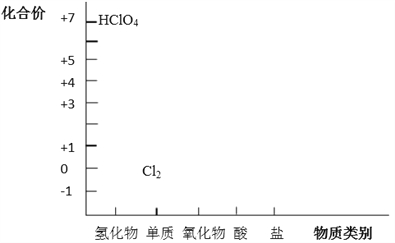
(1)根据图中信息,写出任意两种氯的氧化物的化学式_____________。
(2)写出高氯酸(HClO4)与NaOH反应的化学方程式__________。
(3)HCl既具有氧化性,又具有还原性。
①请任意写出一个体现HCl氧化性的离子方程式__________。
②浓HCl可作为还原剂在加热条件下与MnO2发生反应制备Cl2,写出该反应的化学方程式___________。
(4)Cl2既具有氧化性,又具有还原性,请结合上图说明原因_________。潮湿的Cl2与Na2CO3混合制取少量Cl2O的反应中,Cl2既体现了氧化性,也体现了还原性。写出反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用海水“晒盐”的方法得到的粗盐中,除氯化钠外,还含有氯化镁、氯化钙、硫酸钠等杂质。将此粗盐提纯的部分实验方案如下:
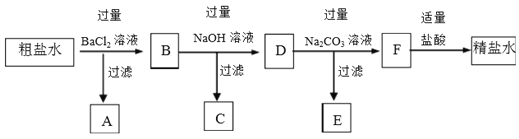
(1)粗盐水中含有的阳离子有_______,阴离子有__________。
(2)加入BaCl2溶液的目的是(用离子方程式表示)_________。
(3)生成沉淀C的离子方程式是______。
(4)D中所含离子有_______。
(5)E的主要成分的化学式是____。
(6)用文字描述加入适量盐酸的目的是________。
(7)某同学认为加入过量K2CO3溶液与加入过量Na2CO3溶液同样可以达到实验目的,这种说法是否合理,请说明理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)═2HCl (g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=
(3)2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图1所示.已知1mol SO2(g)氧化为1mol SO3的△H=﹣99kJmol﹣1 . 请回答下列问题: 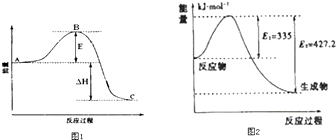
①图中△H=KJmol﹣1;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,
(4)①如图2是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为: .
②若起始时向容器内放入1mol N2和3mol H2 , 达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为;若在同体积的容器中充入2mol N2和6mol H2 , 达平衡后放出的热量为Q2 kJ,则Q22Q1(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com