
分析 (1)硫粉难溶于水、微溶于乙醇,乙醇湿润可以使硫粉易于分散到溶液中;
(2)由于S2O32?具有还原性,易被氧气氧化成硫酸根离子可知杂质为硫酸钠;硫代酸酸钠和盐酸反应生成氯化钠、二氧化硫、单质硫和水;
(3)生成的碘单质遇到淀粉变蓝,用硫代硫酸钠滴定时,当蓝色褪去半分钟不变化,说明反应达到终点;溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; I2+2S2O32-=2I-+S4O62-;I2+SO32-+H2O═2I-+SO42-+2H+,根据方程式列出各物质的关系为2Ba2+~2BaCrO4~Cr2O72-~3 I2~6S2O32-和2BaCrO4~Cr2O72-~3I2~3SO32-计算.
解答 解:(1)硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇湿润是使硫粉易于分散到溶液中,有利于硫粉和Na2SO3溶液充分接触,加快反应速率
故答案为:有利于硫粉和Na2SO3溶液充分接触,加快反应速率;
(2)S2O32?具有还原性,能够被氧气氧化成硫酸根离子,所以可能存在的杂质是硫酸钠,
故答案为:Na2SO4;
(3)依据标定的原理可知,生成的碘单质遇到淀粉变蓝,用硫代硫酸钠滴定当蓝色褪去半分钟不变化,说明反应达到终点;溶液中发生的反应为:2Ba2++Cr2O72-=2BaCrO4+2H+; Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O; I2+2S2O32-=2I-+S4O62-;I2+SO32-+H2O═2I-+SO42-+2H+,
n(Na2S2O3)=0.0360 L×0.100 mol•L-1=0.0036 mol
则n(Na2SO3)=0.00360 mol÷5=0.00072 mol
根据题意:2Ba2+~2BaCrO4~Cr2O72-~3I2~6S2O32-
2 6
n1 0.0036 mol
得n1(Ba2+)=$\frac{0.0036mol×2}{6}$=0.0012 mol
2Ba2+~2BaCrO4~Cr2O72-~3I2~3SO32-
2 3
n2 0.00072mol
得得n2(Ba2+)=$\frac{0.00072mol×2}{3}$=0.00048 mol
则c(Ba2+)=$\frac{0.0012mol+0.00048mol}{0.05L}$=3.36×10-2 mol•L-1,
故答案为:淀粉;蓝色褪去半分钟不变化;3.36×10-2 mol•L-1.
点评 本题综合考查物质的制备以及含量的测定,为高考常见题型,侧重于学生的分析能力、实验能力和计算能力的考查,注意把握实验的原理,结合反应的关系式计算,难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
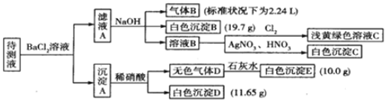
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | Na+ Mg2+ Al3+ Ba2+ Fe3+ |
| 阴离子 | OH- Cl- CO32- SO42- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
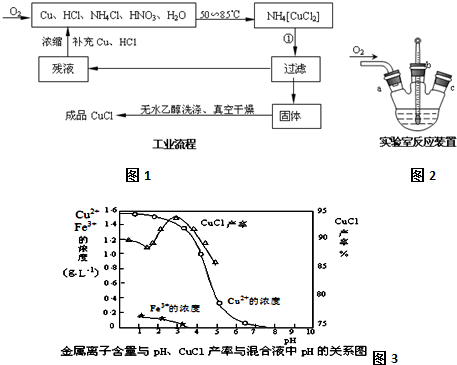
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若D与盐酸反应,可生成A和B,则X一定是H2O | |
| B. | 若D为NaCl,且A可与C反应生成B,则E 可能是CO2 | |
| C. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气通过盛足量溴水的洗气瓶 | |
| C. | 混合气通过盛水的洗气瓶 | |
| D. | 混合气跟氯化氢混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com