
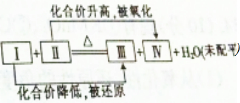
 一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )
一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )| A. | H2SO4 | B. | CuSO4 | C. | Cu | D. | SO2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.7g H2O2中含有的电子数为0.9 NA | |
| B. | 等物质的量的N2和CO所含分子数均为NA | |
| C. | 1mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g CH4含有4NA个电子 | |
| B. | 0.1mol铁和0.1mol铜分别与0.1mol氯气完全反应,转移的电子数均为0.2NA | |
| C. | 标准状况下,11.2L H2O中分子数为0.5NA个 | |
| D. | 0.1mol•L-1 Na2CO3溶液中含有0.2NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol CO、1mol O2 | 2mol CO2 | 4mol CO2 |
| CO2的浓度(mol•L-1) | C1 | C2 | C3 |
| 反应的能量变化 | 放出aKJ | 吸收bKJ | 吸收CkJ |
| 体系压强(Pa) | P1 | P2 | P3 |
| A. | 2c1<c3 | B. | a+b=283.0 | C. | 2p2>p3 | D. | c1=c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的溶液中滴入稀盐酸.放出气体的快慢Na2C03<NaC03 | |
| B. | 热稳定性Na2C03<NaHC03 | |
| C. | 常温时水溶性Na2C03<NaHC03 | |
| D. | 相对分子质量Na2C03<NaHC03 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com