
| A. | $\frac{12n}{m}$ | B. | $\frac{60n}{m}$ | C. | $\frac{11m}{120n}$ | D. | $\frac{120n}{11m}$ |
分析 求出m克FeS2的物质的量,然后根据1molFeS2在氧气中完全燃烧生成SO2和Fe2O3时转移11mol电子来分析.
解答 解:m克FeS2的物质的量n=$\frac{m}{120}$mol,而1molFeS2在氧气中完全燃烧生成SO2和Fe2O3时,铁的价态由+2价变为+3价,S元素由-1价变为+4价,故1molFeS2转移11mol电子,则$\frac{m}{120}$molFeS2转移$\frac{11m{N}_{A}}{120}$个电子,即$\frac{11m{N}_{A}}{120}=n$,则NA=$\frac{120n}{11m}$.故选D.
点评 本题考查氧化还原反应的有关计算、阿伏伽德罗常数等,难度不大,注意基础知识的理解掌握.


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
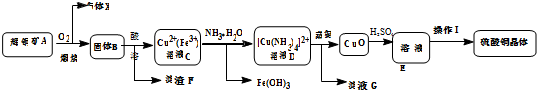

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| B. | H2O2、Na202、SO2都具有漂白性且漂白原理相同 | |
| C. | 饱和Na2C03溶液中通入CO2溶液会变浑浊 | |
| D. | 可用石灰水吸收尾气中的S02气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性H2Y>HZ | B. | 离子半径W3+<Z-,第一电离能X<W | ||
| C. | W、X、Y、Z最高正价与族序数相等 | D. | 电负性Z<Y<W<X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
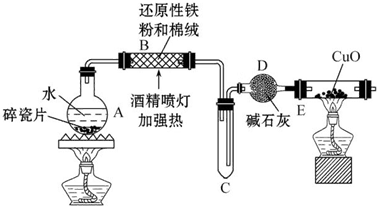
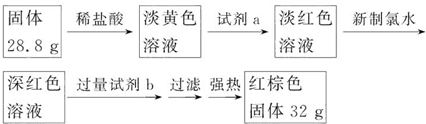
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com