
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为________________________________________________________________________。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________________________________。
科目:高中化学 来源: 题型:
用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊 | 饱和Na2CO3溶液 |
| B | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊 | 澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
卫生部发出公告,自2012年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是 ( )。
A.CaO2具有氧化性,对面粉可能具有增白作用
B.CaO2中阴阳离子的个数比为1∶1
C.CaO2与水反应时,每产生1 mol O2转移电子4 mol
D.CaO2与CO2反应的化学方程式为2CaO2+2CO2===2CaCO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列哪些事实或实验能说明氧化性:Cl2>Br2>I2_____________________________________________________________________
(填序号)。
①氯水分别滴入KBr、NaI溶液中颜色加深,而溴水滴入NaCl溶液中无明显变化,滴入KI淀粉溶液中,溶液变蓝
②H2和Cl2的混合气体光照爆炸,H2和Br2的混合气体加热才能反应,而H2和I2反应更困难
③Fe分别与Cl2、Br2、I2反应生成Fe的化合物的化合价高低
④HCl、HBr、HI的热稳定性越来越差
⑤Cl2、Br2、I2在水中的溶解度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
氢溴酸在医药和石化工业上有广泛用途。模拟工业制备氢溴酸的流程如图所示:
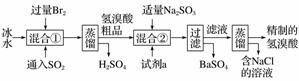
回答下列问题:
(1)混合①中发生反应的离子方程式为___________________。
(2)混合②中加入试剂a是________________________。
(3)加入Na2SO3的目的是除去过量的Br2,但要防止过量,原因是____________________________(请用离子方程式表示)。
(4)工业氢溴酸常带有淡淡的黄色,可能的原因是:①含Fe3+,②含Br2,③含Fe3+和Br2,只用下列一种试剂就能分析产生淡黄色的原因。该试剂是____(填字母)。
a.KMnO4溶液 b.NaOH溶液
c.KSCN溶液 d.淀粉KI溶液
e.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置如图所示(可重复使用,不含制气装置)。下列说法正确的是( )
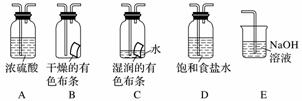
A.按气流流动的先后顺序,装置连接顺序依次为DACBE
B.按气流流动的先后顺序,装置连接顺序依次为DABAE
C.装置E的主要用途是制备NaClO
D.若实验中使用到装置C且有色布条褪色,则说明湿润的氯气有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
运用化学反应原理研究卤族元素的有关性质具有重要意义。
(1)下列关于氯水的叙述正确的是________(填序号)。
a.氯水中存在两种电离平衡
b.向氯水中通入SO2,其漂白性增强
c.向氯水中通入氯气,c(H+)/c(ClO-)减小
d.加水稀释氯水,溶液中的所有离子浓度均减小
e.加水稀释氯水,水的电离平衡向正反应方向移动
f.向氯水中加少量NaOH固体,可能有c(Na+)=c(Cl-)+c(ClO-)
(2)氯气在工业上有着极其广泛的用途。工业上通过氯碱工业生产氯气,其反应的离子方程式为____________________________。室温下,用惰性电极电解100 mL饱和食盐水,当阴极产生标准状况下11.2 mL气体,忽略溶液体积的变化时,所得溶液的pH=__________。
(3)常温下,已知25 ℃时有关弱酸的电离常数:
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7,K2=5.6×10-11 |
写出84消毒液(主要成分为NaClO)露置在空气中发生反应的有关化学方程式________________________________________________________________________。
若将84消毒液与洁厕剂(含有浓盐酸)混合使用可能会导致中毒,请用离子方程式解释有关原因________________________________________________________________________
________________________________________________________________________。
(4)服用含碘化钾的碘药片可抗核辐射。将碘药片剥去糖衣皮研碎后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色。完成并配平溶液由蓝色变为无色的化学反应方程式(如果化学计量数是1,不用填写):______+______+______—→______HIO3+______。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)19世纪末,人们开始揭示原子内部的秘密,最早发现电子的科学家是________。
(2)道尔顿的原子学说曾起了很大的作用。他的学说包含下列三个论点:①原子是不能再分的粒子,②同种元素的原子的各种性质和质量都相同,③原子是微小的实心球体。从现代的观点看,你认为三个论点中不确切的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2 800 | 2 050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com