
| A. | 水结成冰体积膨胀,密度变小 | |
| B. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高 | |
| C. | He、Ne、Ar、Kr、Xe在水中的溶解度逐渐增大 | |
| D. | 水加热到很高的温度都难以分解 |
分析 A、根据氢键对冰的结构、密度的影响判断;
B、CH4、SiH4、GeH4、SnH4中均不含氢键,根据范德华力对物质性质的影响判断;
C、He、Ne、Ar、Kr、Xe为稀有气体单质,气体的分子间不存在氢键;
D、氢键为分子间作用力,与物质的稳定性无关.
解答 解:A、氢键具有方向性,氢键的存在迫使四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引,这一排列使冰晶体中的水分子的空间利用率不高,留有相当大的空隙,所以水结成冰时,体积增大.当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的间隙减小,密度反而增大,故A正确.
B、CH4、SiH4、GeH4、SnH4的熔点随相对分子质量的增大而升高是与分子间作用力有关,分子间不存在氢键,与氢键无关,故B错误;
C、氢键是一种较强的分子间作用力,只可能存在于含有氢元素的化合物的分子间,而He、Ne、Ar、Kr、Xe为稀有气体单质,气体的分子间不存在氢键,故其在水中的溶解度的变化与氢键无关,故C错误;
D、氢键为分子间作用力,与物质的稳定性无关,水加热到很高的温度都难以分解,水分子中的共价键强度大,故D错误;
故选A.
点评 本题考查氢键的知识,题目难度不大,注意氢键只与物质的物理性质有关,与化学性质无关.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

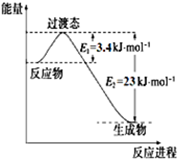
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有金属元素和非金属元素化合时才能形成离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| D. | 含有共价键的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
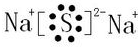 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃,能燃烧的是矿物油 | |
| B. | 加入足量氢氧化钠溶液共热,不分层的是地沟油 | |
| C. | 加入水中,浮在水面上的是地沟油 | |
| D. | 测定沸点,有固定沸点的是矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
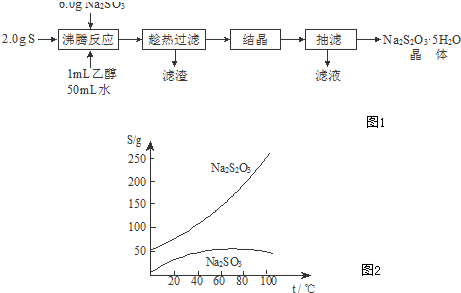
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com