
| A. | 化学反应是旧键断裂和新键形成的过程 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
分析 A.化学反应的实质是:是旧键断裂和新键形成;
B.反应速率与反应是吸热还是放热无关;
C.反应的热效应只与始态、终态有关,与过程无关;
D.反应的热效应只与始态、终态有关,与过程无关.
解答 解:A.化学反应的实质是:是旧键断裂和新键形成,化学反应是旧键断裂和新键形成的过程,故A正确;
B.反应速率与反应是吸热还是放热无关,反应速率与反应物本身的性质及外界条件有关,故B错误;
C.反应的热效应只与始态、终态有关,与过程无关,根据盖斯定律可计算某些难以直接测量的反应焓变,故C正确;
D.反应的热效应只与始态、终态有关,与过程无关,所以同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,故D正确;
故选B.
点评 本题考查化学变化特征、影响反应速率的因素、盖斯定律等,比较基础,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 只发生水合过程 | B. | 只发生化学过程 | ||
| C. | 水合过程放热大于扩散过程吸热 | D. | 扩散过程吸热大于水合过程放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:K+、Cu2+、SO42-、NO3- | |
| B. | 在含Fe3+的溶液中:NH4+、Na+、Cl、OH- | |
| C. | 在强碱溶液中:Na+、K+、Cl-、CO32- | |
| D. | 在强酸性的溶液中:K+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有1个电子的原子都是碱金属 | |
| B. | 最外层有5个电子的原子都是非金属原子 | |
| C. | 稀有气体原子最外层都达到8电子稳定结构 | |
| D. | 过渡元素原子的最外层都不超过2个电子,都是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
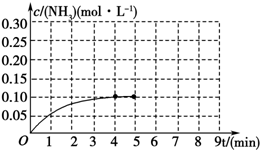 在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0 反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com