
| A. | 用酒精可以提取某些花香中的酯类香精制成香水,利用了酯的某种化学性质 | |
| B. | 煤中含有苯、二甲苯等,可以通过煤的干馏得到,并将它们分离 | |
| C. | 饮用矿泉水瓶的主要成分是聚氯乙烯 | |
| D. | 在海轮外壳镶嵌锌块,能减缓轮船的腐蚀,是利用牺牲阳极的阴极保护法 |
分析 A.该反应为萃取现象,属于物理变化;
B.煤中不含苯和二甲苯;
C.聚氯乙烯有毒,不能制作矿泉水瓶;
D.活泼性比Fe强的锌作负极失电子被腐蚀,Fe作正极被保护.
解答 解:A.用酒精可以提取某些花香中的酯类香精,是因为酒精是有机物,酯类香精在酒精中的溶解度大于在水中的溶解度,这是利用的原理是萃取,属于物理性质,故A错误;
B.煤的组成以有机质为主体,构成有机高分子的主要是碳、氢、氧、氮等元素,煤不含苯和二甲苯等,故B错误;
C.聚氯乙烯有毒,不能盛放饮用水,饮用矿泉水瓶的主要成分是聚乙烯,故C错误;
D.利用牺牲阳极的阴极保护法防止钢铁腐蚀时,活泼性比Fe强的锌作负极失电子被腐蚀,Fe作正极被保护,故D正确;
故选D.
点评 本题考查物质组成、结构和性质的关系,涉及原电池原理、有机物组成、结构与性质等知识,为高考常见题型和高频考点,题目难度不大,有利于培养学生的良好科学素养,注意相关基础知识的积累,.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2}{3}$ | B. | $\frac{1}{2}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
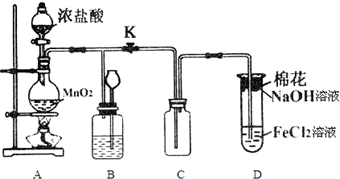
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅燃烧产物对环境产生的污染,容易得到有效控制 | |
| B. | 硅燃烧可以放出较多的热量 | |
| C. | 自然界中硅的贮存量丰富,可以从自然界直接获得单质硅 | |
| D. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 种 | B. | 12 种 | C. | 15 种 | D. | 18 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
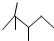 ,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则:
,有机物 B 与等物质的量的 H2发生加成反应可得到有机物 A.则:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 盐在化学工业中有重要的应用,请回答下列问题
盐在化学工业中有重要的应用,请回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com