
【题目】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期;E元素原子核外电子有17种不同的运动状态,F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态。请回答下列问题:
(1)B原子的L层轨道表达式_________;D元素原子的价电子排布式是___________。
(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中σ键和π键的数目之比为_____, B、C的氢化物中BH3的沸点高于 CH3的沸点,原因是______;C、D和E的电负性由大到小的顺序为______;C、D和E的第一电离能由大到小的顺序是______;C和D最高价含氧酸的酸性由弱到强的顺序为_________。CO![]() 中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
中C的杂化方式为________,该离子的“VSEPR”模型为__________形。
(3)向FDO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为_________,该离子的配位体为____________。
(4)D(黑球)和F(白球)形成的某种晶体的晶胞如图所示,已知该晶胞的棱长为516 pm,则该晶胞的密度为___________g/cm3,(列出计算式即可,不必计算结果,阿伏加德罗常数值为NA),最近的黑球和白球之间的距离为____________pm。

【答案】 ![]() 3s23p4 3︰1 NH3分子间可以形成氢键 Cl>S>P Cl>P>S H3PO4<H2SO4 sp3杂化 正四面体 [Cu(NH3)4]2+ NH3 4.6 129
3s23p4 3︰1 NH3分子间可以形成氢键 Cl>S>P Cl>P>S H3PO4<H2SO4 sp3杂化 正四面体 [Cu(NH3)4]2+ NH3 4.6 129![]()
【解析】前四周期元素A、B、C、D、E、F的原子序数依次增大,A是宇宙中含量最丰富的元素,则A为氢元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍,则B为氮元素,C为磷元素; E元素原子核外电子有17种不同的运动状态,则E为氯元素,D和C同一周期且原子序数介于C与E之间,故D为硫元素;F位于第四周期,其未成对电子数只有一个,且内层都处于全充满状态,则F为铜元素。(1)B是氮元素,其原子的L层轨道2p轨道半充满的稳定状态,其表达式为![]() ;D为硫元素,其原子的价电子排布式是3s23p4;(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中有三个σ键和一个π键,比值为3:1;NH3分子间可以形成氢键,故NH3的沸点高于 同主族的其他氢化物的沸点;同周期元素从左而右电负性逐渐增强,故电负性由大到小的顺序为Cl>S>P;其中磷原子3p轨道为半充满稳定状态,第一电离能比同周期相邻原子的大,故第一电离能由大到小的顺序是:Cl>P>S;同周期元素从左到右非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,故酸性由弱到强的顺序为:H3PO4<H2SO4;CO43-离子中价层电子对=4+0=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体;(3)向CuSO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为[Cu(NH3)4]2+,该离子的配位体为NH3;(4)S(黑球)和Cu(白球)形成的某种晶体的晶胞如右图所示,一个晶胞中S位于晶胞的顶点和面心,Cu位于晶胞波内部,一个晶胞中含有S:8×
;D为硫元素,其原子的价电子排布式是3s23p4;(2)由A、B原子形成的分子的结构式为:A-B=B-A,则该分子中有三个σ键和一个π键,比值为3:1;NH3分子间可以形成氢键,故NH3的沸点高于 同主族的其他氢化物的沸点;同周期元素从左而右电负性逐渐增强,故电负性由大到小的顺序为Cl>S>P;其中磷原子3p轨道为半充满稳定状态,第一电离能比同周期相邻原子的大,故第一电离能由大到小的顺序是:Cl>P>S;同周期元素从左到右非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,故酸性由弱到强的顺序为:H3PO4<H2SO4;CO43-离子中价层电子对=4+0=4,所以中心原子原子轨道为sp3杂化,其VSEPR模型为正四面体;(3)向CuSO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为[Cu(NH3)4]2+,该离子的配位体为NH3;(4)S(黑球)和Cu(白球)形成的某种晶体的晶胞如右图所示,一个晶胞中S位于晶胞的顶点和面心,Cu位于晶胞波内部,一个晶胞中含有S:8×![]() +6×
+6×![]() =4个,含有4个Cu,即一个CuS晶胞含有4个S2-和4个Cu2+,晶胞的体积为(516×10-10 cm)3,则晶胞的密度为
=4个,含有4个Cu,即一个CuS晶胞含有4个S2-和4个Cu2+,晶胞的体积为(516×10-10 cm)3,则晶胞的密度为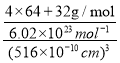 =4.6 g/cm3;四个Cu2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
=4.6 g/cm3;四个Cu2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为![]() a;
a; ![]() a,即可求出斜边为
a,即可求出斜边为![]() a(a 为晶胞边长),则a位置S2﹣离子与b位置Cu2+离子之间的距离为
a(a 为晶胞边长),则a位置S2﹣离子与b位置Cu2+离子之间的距离为![]() ×516pm=129
×516pm=129![]() pm。
pm。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的相对位置如图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )

A. 在三种元素形成的气态氢化物中,Y的气态氢化物最稳定
B. Z元素的氧化物对应的水化物一定是一种强酸
C. 三种元素原子半径的大小顺序为:X>Y>Z
D. Z的单质与Fe反应生成的化合物中,铁元素显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酯化反应、硝化反应、水解反应均属于取代反应
B.由乙醇生成乙烯的反应与乙烯生成溴乙烷的反应类型相同
C.石油的裂解是化学变化,而石油的分馏和煤的气化是物理变化
D.蛋白质、糖类、油脂均是能发生水解反应的天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. AlCl3溶液中加入足量的氨水:Al3++ 3OH-= Al(OH)3↓
B. 向H2O中投入少量Na2O2固体:2H2O+2Na2O2=2Na++ 2OH-+O2↑
C. 氯化铁溶液与铜粉反应:Cu+Fe3+=Fe2++Cu2+
D. Cu与稀硝酸的反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,将22.4 L氯化氢溶于足量水中,溶液中含有的氯化氢分子数为NA
B.合成氨反应达平衡时,形成NA个![]() 键的同时,就有6NA个N—H键形成
键的同时,就有6NA个N—H键形成
C.1 mol乙烯分子中含有5NA个共用电子对
D.16 g CH4与18 g ![]() 所含的质子数均为10NA
所含的质子数均为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在进行分液操作实验时需用到的玻璃仪器是烧杯和___________,在进行分液时,首先要对其进行____________,已知苯与CCl4类似,可用作萃取碘水中的碘,其密度为0.875 g/mL,现用其萃取碘水中的碘,振荡后其上层为_____________色。
II、下图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。

(l)图中有两处明显的错误是:①__________;②___________。
(2)B仪器的名称是__________;C仪器的名称是_____________。
(3)实验时B中除加入少量自来水外,还需要加入少量的____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
请回答下列问题:
(1)CH2=CH-CH2Br的名称为_________。
(2)反应①的反应类型是_____,1,3-丁二烯能够加聚合成聚丁二烯,写出反式聚丁二烯的结构简式_____。
(3)下列有关物质B的说法正确的是_____
A.分子式为C7H9O B.既可以发生氧化也可以发生还原反应
C.可以使酸性高锰酸钾溶液和溴水褪色,原理完全一样 D.核磁共振氢谱中有6组峰
(4)写出反应②的化学反应方程式:________
(5)化合物E是化合物A( )的同系物,分子量比A小28,B有多种同分异构体,满足下列条件的共有________种(不考虑立体异构)。
)的同系物,分子量比A小28,B有多种同分异构体,满足下列条件的共有________种(不考虑立体异构)。
①能发生银镜反应
②能使溴的四氯化碳溶液褪色
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备 的合成路线__________。
的合成路线__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com