
| A.[Na+]>[S2-]>[OH-]>[HS-]>[H+] |
| B.[Na+]+[H+]==[S2-]+[HS-]+[OH-] |
| C.[Na+]==[HS-]+2[H2S]+2[S2-] |
| D.[OH-]==[H+]+[HS-]+[H2S] |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:不详 题型:单选题
| A.若HA为弱酸,BOH为弱碱,则有C(H+)+C(B+)===C(OH-)+ C(A-) |
| B.若HA为强酸,BOH为弱碱,则有C(A-)>C(B+) >C(H+) >C(OH-) |
| C.若HA为弱酸,BOH为强碱,则有C(B+) >C(A-) >C(OH-) >C(H+) |
| D.若HA为强酸,BOH为强碱,则有C(H+)= C(A-)= C(B+)= C(OH-)=0.1mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.托盘天平(带砝码、镊子) | B.滴定管 | C.100mL的量筒 | D.100mL的容量瓶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.x=y | B.x >y | C.x=10-2y | D.x=102y |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
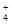 )与c(SO
)与c(SO )之比是 ( )
)之比是 ( )| A.等于2∶1 | B.大于 2∶1 | C.小于2∶1 | D.无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 氢氧化钡溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.PH=7的溶液 | B.c(H+)=10-7mol/L的溶液 |
| C.酸碱恰好完全中和的溶液 | D.c(H+)= c(OH-)=3.5×10-7mol/L的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com