

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、1 mol CO2 |
| B、标准状况下44.8 L H2 |
| C、3 NA 个水分子 |
| D、1 L 1 mol/L的硫酸钠溶液中所含的溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 事实 | 结论 |
| A | 甲、乙两种有机物具有相同相对分子质量和不同结构. | 甲和乙一定是同分异构体. |
| B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水. | 甲、乙两种分子中,各元素的原子个数比一定相同. |
| C | 在苯酚钠的水溶液中通入少量二氧化碳,溶液中出现浑浊. | 生成碳酸钠和苯酚,说明碳酸的酸性比苯酚强. |
| D | 不存在两种邻二甲苯. | 苯分子中碳碳键完全相同,而不是单双键交替结构. |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
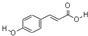
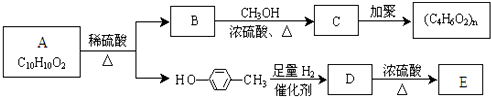
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 |
| C、酒精灯着火时可用湿布扑灭 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com