
(4分)(2012?广东)下列应用不涉及氧化还原反应的是( )
A.Na2O2用作呼吸面具的供氧剂
B.工业上电解熔融状态的Al2O3制备Al
C.工业上利用合成氨实现人工固氮
D.实验室用NH4Cl和Ca(OH)2制备NH3
科目:高中化学 来源:2013-20147山东省乳山市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列关于有机物的说法正确的是
A.常在燃料乙醇中添加少量煤油以区分食用乙醇,乙醇和煤油都是石油分馏产品
B.葡萄糖、果糖的分子式虽均为C6H12O6,但二者不是同分异构体
C.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
D.合成纤维、人造纤维及碳纤维都属于有机高分子材料
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(浙江卷解析版) 题型:简答题
[14分]已知:I2+2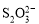

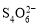 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2?2H2O晶体,加入 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________;
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2?2H2O晶体。
(2)在空气中直接加热CuCl2?2H2O晶体得不到纯的无水CuCl2,原因是_______________。(用化学方程式表示)。由CuCl2?2H2O晶体得到纯的无水CuCl2的合理方法是_______。
(3)某学习小组用“间接碘量法”测定含有CuCl2?2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示荆,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2?2H2O的质量百分数为___________________________。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(新课标解析版) 题型:选择题
分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:填空题
(14分)(2012?广东)过渡金属催化的新型碳﹣碳偶联反应是近年来有机合成的研究热点之一,如:
反应①
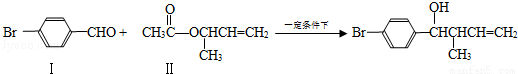
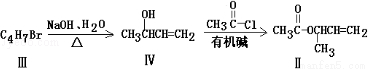
化合物Ⅱ可由化合物Ⅲ合成:
(1)化合物Ⅰ的分子式
(2)化合物Ⅱ与Br2加成的产物的结构简式为
(3)化合物Ⅲ的结构简式为
(4)在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应的方程式为 (注明反应条件),因此,在碱性条件下,由Ⅳ与CH3CO﹣Cl反应生成Ⅱ,其反应类型为 .
(5)Ⅳ的一种同分异构体Ⅴ能发生银镜反应,Ⅴ与Ⅱ也可以发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为 (写出其中一种).
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(山东卷解析版) 题型:填空题
(12分)(2012?山东)[化学﹣物质结构与性质]金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是 .
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 .
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .CO与N2结构相似,CO分子内σ键与π键个数之比为 .
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为 ,甲醇分子内的O﹣C﹣H键角 (填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(山东卷解析版) 题型:选择题
(3分)(2012?山东)下列实验操作正确的是( )
A.中和滴定实验时,用待测液润洗锥形瓶
B.盛放NaOH溶液时,使用带玻璃塞的磨口瓶
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
查看答案和解析>>
科目:高中化学 来源:2012-2014四川省宜昌市春季期中考试高一化学试卷(解析版) 题型:填空题
(12分)甲同学拟通过实验探究同主族元素性质的递变规律,以及影响化学反应速率的因素。其设计的实验方案如下,请你帮他填写完整,并做出评价。
实验室提供的试剂:锌块、锌粉、铁条、铁粉、铜条、NaBr溶液、NaI溶液、新制的氯水、1mol/L盐酸、3mol/L的盐酸
(1)探究同主族元素性质的递变规律
①写出下列实验报告中的实验现象和离子方程式
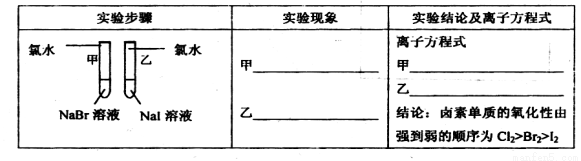
②【评价】甲同学设计的实验方案的合理性是___________(填序号)
A. 非常合理B. 部分合理C. 完全不合理
③【补充和完善】上一题②中若选A,则此项不用再作答,若选B或C,则完成实验还需要的试剂是___________。
(2)探究影响化学反应速率的因素
实验步骤 | 实验现象 | 实验依据和结论 |
3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) | 均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快。 |
甲同学所得实验依据和结论有明显问题,问题是 。
(3)请你利用原电池原理,设计实验,比较铜和铁的金属活动性。画出实验装置图,标出正负极、电子流动方向,写出电极反应式。
查看答案和解析>>
科目:高中化学 来源:2012-2013陕西省富平县高一下学期期末考试化学试卷(解析版) 题型:选择题
在元素周期表中,同主族元素的原子具有相同的 ( )
A.最外层电子数 B.核电荷数 C.电子层数D.核外电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com