
标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示不正确的是
A.体积:④<①<②<③ B.密度:①<④<③<②
C.质量:④<①<③<② D.氢原子数:②<④<③<①
A
【解析】
试题分析:①6.72L CH4 物质的量为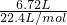 =0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6g H2S 的物质的量为
=0.3mol,②3.01×1023个HCl分子的物质的量为0.5mol,③13.6g H2S 的物质的量为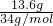 =0.4mol,④0.2mol NH3.相同条件下,气体的体积之比等于物质的量之比,所以体积②>③>①>④,A错误;各物质的摩尔质量分别为①CH4 为16g/mol②HCl为36.5g/mol ③H2S 为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,B正确;各物质的质量分别为①CH4 为0.3mol×16g/mol=4.8g②HCl为0.5mol×36.5g/mol=33.25g ③H2S 13.6g④NH3为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,C正确;各物质中H原子的物质的量分别为①CH4 为0.3mol×4=1.2mol②HCl为0.5mol③H2S 0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,D正确.选A。
=0.4mol,④0.2mol NH3.相同条件下,气体的体积之比等于物质的量之比,所以体积②>③>①>④,A错误;各物质的摩尔质量分别为①CH4 为16g/mol②HCl为36.5g/mol ③H2S 为34g/mol④NH3为17g/mol,相同条件下,密度之比等于摩尔质量之比,所以密度②>③>④>①,B正确;各物质的质量分别为①CH4 为0.3mol×16g/mol=4.8g②HCl为0.5mol×36.5g/mol=33.25g ③H2S 13.6g④NH3为0.2mol×17g/mol=3.4g,所以质量②>③>①>④,C正确;各物质中H原子的物质的量分别为①CH4 为0.3mol×4=1.2mol②HCl为0.5mol③H2S 0.4mol×2=0.8mol④NH3为0.2mol×3=0.6mol,所以氢原子个数①>③>④>②,D正确.选A。
考点:考查常用化学计量有关计算、阿伏伽德罗定律及推论。


科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高二上学期第一次月考化学试卷(解析版) 题型:选择题
室温下,某无色透明溶液中由水电离出来的H+和OH—浓度的乘积为1×10—24,则此溶液中可能大量共存的离子组为( )
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、SO32-、Na+、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:选择题
下列溶液,一定呈中性的是
A.由等体积、等物质的量浓度的一元酸跟NaOH溶液混合后所形成的溶液
B.c(H+)=1.0×10-7mol·L-1的溶液
C.pH=14-pOH的溶液
D.pH=pOH的溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:填空题
(6分)在四个脱落标签的试剂瓶中,分别盛有盐酸、BaCl2溶液、Na2CO3溶液、AgNO3溶液,为了鉴别各瓶中的试剂将它们分别编号为A、B、C、D并两两混合,其实验现象为:A+B能产生无色气体;B+C能产生白色沉淀;A+D能产生白色沉淀;A+C无明显变化。
(1)由此推出各试剂瓶所盛的试剂为(填化学式):
A:________,B:________,C________,D________。
(2)A+B反应的离子方程式为___________________________。
(3)A+D反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:选择题
在Na2SO4、NaCl、NaOH的混合溶液中,含有Na+、SO42-、OH-的个数比是8∶1∶2,则溶液中Na2SO4、NaCl、NaOH的物质的量之比是
A.1∶1∶1 B.1∶4∶2 C.1∶2∶4 D.1∶3∶2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:选择题
根据下列化学方程式判断物质氧化性或还原性强弱排序正确的是
① 2FeCl3+Cu=2FeCl2+CuCl2 ②CuCl2+Fe=FeCl2+Cu
A.还原性:Fe > Cu>FeCl2 B.还原性:Fe > FeCl2> Cu
C.氧化性:CuCl2>FeCl3>FeCl2 D.氧化性:FeCl3 >FeCl2>CuCl2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:选择题
下列反应既是氧化还原反应又是离子反应的是
A.钠在氯气中燃烧 B.二氧化碳通入澄清的石灰水中
C.氯化钠溶液中滴加硝酸银溶液 D.锌粒放入稀硫酸中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第一次月考化学试卷(解析版) 题型:填空题
(15分)在下图中,E和F分别为电源两极;甲烧杯中盛有100 mL 0.2mol·L-1 AgNO3溶液,乙烧杯中盛有100 mL 0.15 mol·L-1 CuCl2溶液,A、B、C、D均为石墨电极,如果电解一段时间后,发现B极增重1.08g,则

(1)E为________极,C为________极。
(2)A极的电极反应式为_________________________,析出气体________mL。(标准状况)
(3)若乙烧杯溶液体积不变,则此时溶液的物质的量浓度将变为 mol·L-1。
(4)甲烧杯中滴入石蕊试液,________极附近变红(填A或B);如果继续电解,在甲烧杯中最终得到________溶液(填溶质的化学式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省厦门市高一上学期期中考试化学试卷(解析版) 题型:实验题
(7分)选用如下实验装置组合后完成用浓盐酸、二氧化锰共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉的实验。已知①工业制漂白粉反应为放热反应。②温度稍高即发生副反应6Cl2+6Ca(OH)2==5CaCl2+Ca(ClO3)2+6H2O。

⑴选用各装置的接口顺序为 (填图中小写英文字母)。
⑵制漂白粉的装置选择 (填C或D)装置的原因
。
F装置的作用是
写出F中发生反应的化学方程式
⑶实验中若用12mol﹒L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的主要原因是
(假定各步反应均无反应物损耗且无副反应发生)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com