
 表示碳原子,用
表示碳原子,用  表示氧原子,用
表示氧原子,用  表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: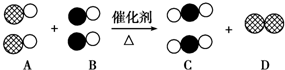
分析 (1)根据含有元素分析判断;
(2)由两种或两种以上元素构成的纯净物是化合物,由一种元素构成的纯净物是单质;
(3)同一化学反应中,分子数之比等于其计量数之比,同一方程式中,各物质的质量之比等于其计量数与相对分子质量之积的比.
解答 解:根据题意及图示可知:A为NO、B为CO、C为CO2、D为N2,
(1)根据A、B、C含有元素种类知,这三种物质都含有氧元素,所以都属于氧化物,可以归为一类,
故答案为:都含有氧元素;
(2)C为CO2,D为N2,二氧化碳含有两种元素,氮气含有一种元素,所以二氧化碳是化合物,氮气是单质,
故答案为:二氧化碳分子是由2个氧原子和1个碳原子构成的,氮气分子是由2个氮原子构成的;
(3)同一化学反应中,分子数之比等于其计量数之比,所以该反应方程式为:2CO+2NO$\frac{\underline{催化剂}}{△}$N2+2CO2,A为NO、C为CO2,化学变化过程中消耗的A物质和生成的C物质的质量比=2×(14+16):2×(12+2×16)=15::22,
故答案为:2CO+2NO$\frac{\underline{催化剂}}{△}$N2+2CO2;15:22.
点评 本题从宏观、微观方面考查了化学反应,根据反应前后元素守恒、质量守恒结合单质、化合物的定义来分析解答即可,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应 | |
| B. | 氟的非金属性比氯强,其最高价氧化物对应水化物的酸性比HClO4强 | |
| C. | 硒(Se)位于第四周期 VIA,其气态氢化物不如HCl稳定 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应I2(g)+H2(g)?2H I(g) 达平衡后,压缩体积体系颜色变深 | |
| B. | H2O2中加入二氧化锰,生成氧气的速率加快 | |
| C. | 棕黄色的FeCl3溶液中加入铁粉颜色逐渐变为浅绿色 | |
| D. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4+Ba(OH)2═BaSO4↓+2H2O | B. | 2HCl+Ba(OH)2═BaCl2+2H2O | ||
| C. | H2SO4+Cu(OH)2═CuSO4+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、Cl-、SO42- | B. | Na+、Fe2+、Cl-、SO42- | ||
| C. | Na+、SO42-、Cl-、ClO- | D. | NH4+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com