
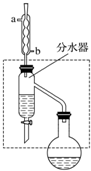
 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:CH3COOH+CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$ CH3COOCH2CH2CH2CH3+H2O| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
分析 (1)冷凝管冷却时,采用逆流冷却的效果好;生成乙酸丁酯的反应为可逆反应,生成物有水,分离生成的水,使平衡正向移动,提高反应产率;
(2)①根据各物质的溶解性及性质进行排序;
②乙酸丁酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应而被吸收,硫酸与碳酸钠反应;
③根据乙酸异戊酯的密度及正确的分液操作方法进行解答;
(3)实验过程中收集124℃-126℃的馏分,称得质量为7.0g为实际得到乙酸正丁酯的质量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:(1)冷凝管冷却时,采用逆流冷却的效果好,所以冷水从b进,生成乙酸丁酯的反应为可逆反应,生成物有水,分离生成的水,使平衡正向移动,提高反应产率,所以要通过分水器不断分离除去反应生成的水,
故答案为:b;分离生成的水,使平衡正向移动,提高反应产率;
(2)①因为正丁醇和乙酸都具有挥发性,所以制取的酯中含有正丁醇和乙酸,第一步水洗除去酯中的正丁醇和乙酸;第二步用10%碳酸钠洗涤除去乙酸;第三步用水洗涤除去碳酸钠溶液;第四步用无水硫酸镁干燥除去水;第五步蒸馏,制得较纯净的酯,
故选C;
②制备乙酸丁酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸丁酯的香味,溶解挥发出来的乙醇;降低乙酸丁酯在水中的溶解度,便于分层得到酯,
故答案为:除去产品中含有的乙酸、硫酸等杂质;
③由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d,
故选d;
(3)12.0mL正丁醇的质量为12.0mL×0.8g/mL=9.6g,设12.0mL正丁醇理论上生成酯物质的量为x,
根据反应CH3COOH+CH3CH2CH2CH2OH$\frac{\underline{\;浓硫酸\;}}{△}$CH3COOCH2CH2CH2CH3+H2O
74g 116g 18g
9.6g xg
$\frac{74g}{9.6g}=\frac{116g}{xg}$,
x=15.05g,当反应生成的水体积为1.8mL即为1.8g时,实际产量为11.6g,所以产率=$\frac{11.6g}{15.05g}$×100%=77.1%,
故答案为:77.1%.
点评 本题考查了乙酸正丁酯的制取方法,侧重考查了灵活运用基础知识解决实际问题的能力,有利于培养学生的实验能力,和严禁的逻辑思维能力,注意实验化学来源于常规实验和基本操作的综合应用,题目难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-3 mol•L-1 | 1.00 | 0.25 | 0.16 | 0.10 | 0.10 |
| c(CO)/10-3 mo l•L-1 | 3.60 | 2.85 | 2.76 | 2.70 | 2.70 |
| A. | 0~2 s间的平均反应速率v(NO)=3.75×10-3mol/(L•s) | |
| B. | 催化转化器对废气的转化速率在冬季时比夏季时高 | |
| C. | 选用更有效的催化剂可以提高污染物的转化率 | |
| D. | 该温度下,此反应的平衡常数K=5.0×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x值为1 | B. | 混合气体的密度增大 | ||
| C. | 平衡时N的浓度为 0.6 mol/L | D. | N的转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
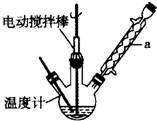 甲苯(
甲苯(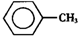 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(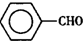 )、苯甲酸(
)、苯甲酸(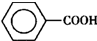 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用物质A表示的反应的平均速率为0.6mol•L-1•s-1 | |
| B. | 用物质B表示的反应的平均速率为0.6mol•L-1•s-1 | |
| C. | 2s时物质A的转化率为70% | |
| D. | 2s时物质B的物质的量为 1.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 0.068 MPa-1 | B. | 0.082 | C. | 0.072 MPa-1 | D. | 0.082 MPa-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| B. | 一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-2akJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=-114.6kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
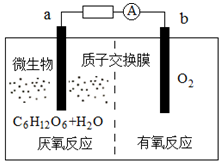 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( )| A. | b极为正极,发生氧化反应 | |
| B. | 外电路中电子的移动方向为:b→a | |
| C. | 质子通过交换膜从b极区移向a极区 | |
| D. | 电池总反应为C6H12O6+6O2=6CO2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com