
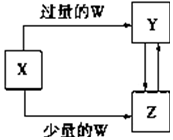
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )| 选项 | W | X |
| A | 稀硫酸 | NaAlO2溶液 |
| B | 稀硝酸 | Fe |
| C | CO2 | Ca(OH)2溶液 |
| D | Cl2 | Fe |
| A. | A | B. | B | C. | C | D. | D |
分析 A、W为稀硫酸、X为NaAlO2溶液,则Y为硫酸铝,Z为氢氧化铝;
B、W为稀硝酸、X为Fe,则Y为硝酸铁,Z为硝酸亚铁;
C、W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化;
D、W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁;
解答 解:A、W为稀硫酸、X为NaAlO2溶液,则Y为硫酸铝,Z为氢氧化铝,硫酸铝通入二氧化碳转化为氢氧化铝,氢氧化铝与硫酸反应生成硫酸铝,所以可以实现以上转化,故A不选;
B、W为稀硝酸、X为Fe,则Y为硝酸铁,Z为硝酸亚铁,硝酸铁与铁反应生成硝酸亚铁,硝酸亚铁与硝酸反应生成硝酸--所以可以实现以上转化,故B不选;
C、W为CO2、X为Ca(OH)2溶液,则Y为碳酸氢钙,Z为碳酸钙,二者可以相互转化,碳酸钙和二氧化碳、水反应生成碳酸氢钙,碳酸氢钙分解生成碳酸钙,故C不选;
D、W为Cl2、X为Fe,铁和氯气反应只能生成氯化铁,不能生成不同价态的化合物,故D错误;
故选D.
点评 本题考查元素化合物的推断,解题关键是根据已知信息结合化合物的性质分析、尝试确定各物质,各物质确定后抓住化学性质解决问题.本题涉及知识点较多,难度较大.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.20 | |
| 4 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
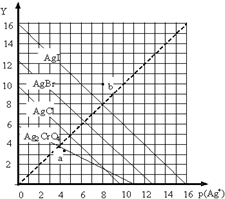 一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )
一定温度下,卤化银AgX(X:Cl-、Br-、I-)及Ag2CrO4的沉淀溶解平衡曲线如图示.横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“-lgc(X-)”或“-lgc(CrO42-)”.下列说法正确的是( )| A. | a点表示c(Ag+)=c(CrO42-) | |
| B. | b点可表示AgI的饱和溶液 | |
| C. | 该温度下AgI的Ksp约为1×10-16 | |
| D. | 该温度下AgCl、AgBr饱和溶液中:c(Cl-)<c(Br-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶可用作加热的反应器 | |
| B. | 室温下,不能将浓硫酸盛放在铁桶中 | |
| C. | 在50mL量筒中配置0.1000mol•L-1碳酸钠溶液 | |
| D. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 42g NaHCO3晶体中含有CO32-的数目为0.5NA | |
| B. | 1 mol OH-和17 g NH3所含的电子数相等 | |
| C. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| D. | 2.0g H216O与D216O的混合物中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7 mol | |
| D. | CO的平衡转化率为80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+═Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 产生1 g H2,消耗锌的质量65 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com