
工业上,通过如下转化可制得KClO3晶体:
NaCl溶液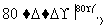 NaClO3溶液
NaClO3溶液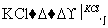 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+
NaCl+ H2O===
H2O=== NaClO3+
NaClO3+ __________。
__________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是________________________________________________________________________。
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
短周期元素X、Y、Z最外层电子数之和为15,X、Y在同一周期,X+、Z-具有相同的核外电子层结构。下列推测错误的是 )。
A.同主族元素中Z的氢化物稳定性最强
B.同周期元素中X的金属性最强
C.原子半径X>Y,离子半径X+>Y-
D.同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,在高温下不能自发进行的是( )
A.CO(g)===C(s)+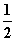 O2(g)
O2(g)
B.2N2O5(g)===4NO2(g)+O2(g)
C.(NH4)2CO3(s)===NH4HCO3(s)+NH3(g)
D.MgCO3(s)===MgO(s)+CO2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是( )
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠的氧化性
C.反应中生成1 mol Na2H3IO6转移2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
用Pt电极电解含有Cu2+和X3+各0.1 mol的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系如图所示。则下列氧化性强弱的判断正确的是( )
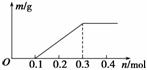
A.Cu2+>X3+>H+>X2+
B.X3+>H+>Cu2+>X2+
C.X3+>Cu2+>H+>X2+
D.X2+>H+>Cu2+>X3+
查看答案和解析>>
科目:高中化学 来源: 题型:
做实验时不小心沾在皮肤上的高锰酸钾会形成黑斑,很久才能消除,若用乙二酸的稀溶液擦洗黑斑,黑斑可以迅速褪去,其反应的离子方程式为
MnO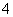 +H2C2O4+H+—→CO2↑+Mn2++
+H2C2O4+H+—→CO2↑+Mn2++
下列有关此反应的叙述正确的是( )
A.乙二酸中C显+2价
B.反应的离子方程式右侧方框内的产物是OH-
C.氧化剂和还原剂的化学计量数之比是5∶2
D.若有6 mol H+参加反应,则转移电子10 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列平衡常数K表示反应进行的程度,K越大,表示反应进行得 越彻底。关于化学平衡常数的叙述不正确的是( )
越彻底。关于化学平衡常数的叙述不正确的是( )
A.温度一定,一个化学反应的平衡常数不变
B.两种物质反应,不管怎样书写化学方程式,平衡常数不变
C.温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数
D.从平衡常数的大小可以推断一个反应进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于乙酸的说法正确的是( )
A.冰醋酸是冰和醋酸的混合物
B.用分液的方法分离乙酸和乙醇的混合物
C.羧酸能发生取代反应
D.羧酸均不能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有Mg、Al混合粉末10.2 g,将它溶于500 mL 4 mol·L-1的盐酸里,若要使沉淀质量达到最大值,则需加入2 mol·L-1氢氧化钠溶液的体积为( )
A.1 000 mL B.500 mL C.100 mL D.1 500 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com