
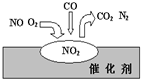
 在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法错误的是( )
在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法错误的是( )| A、NO2是红棕色气体 | ||||
| B、NO和O2必须在催化剂表面才能反应 | ||||
| C、汽车尾气的主要污染成分包括CO和NO | ||||
D、催化转化总反应为:2NO+O2+4CO
|
| ||
| ||
| ||


科目:高中化学 来源: 题型:
 已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ?mol-1.
已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4 kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氮、磷化合物的生活污水大量排放可使水体富营养化,造成潮汐 |
| B、各国工业大量排放二氧化硫是全球气候变暖的主要原因 |
| C、劣质装修材料中的甲醛、苯、氡气等对人体有害 |
| D、废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、△H2>△H3 |
| B、△H1<△H3 |
| C、△H1+△H3=△H2 |
| D、△H1+△H2=△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com