
【题目】多数有机物都可以燃烧而发生氧化反应,下列有机物完全燃烧时,生成的CO2与H2O的物质的量相等的是( )
A.甲烷
B.乙烯
C.苯
D.乙醇
科目:高中化学 来源: 题型:
【题目】已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H22NH3 | |||
起始浓度mol/L | 1.0 | 3.0 | 0 |
2秒末浓度mol/L | 0.6 | 1.8 | a |
A.0.2mol/(Ls)
B.0.4mol/(Ls)
C.0.6mol/(Ls)
D.0.8mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
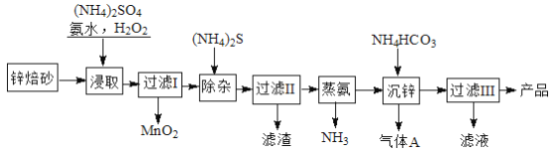
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),ΔH<0,800℃下,在2 L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g),ΔH<0,800℃下,在2 L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
n/mol | 0.30 | 0.20 | 0 | 0 |
①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的化学反应速率v(CO2)=___________________;平衡时,容器中CO的转化率为_____________
②下图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是_______________(写出一条即可)。
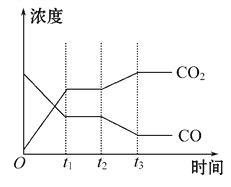
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g)降低其浓度。某温度下,在两个容器中进行上述反应,容器中各物质的浓度及正、逆反应速率关系如下表所示,并请在表中的空格处填写“>”“<”或“=”。
CO2(g)降低其浓度。某温度下,在两个容器中进行上述反应,容器中各物质的浓度及正、逆反应速率关系如下表所示,并请在表中的空格处填写“>”“<”或“=”。
容器 编号 | c(CO)/ mol·L-1 | c(O2)/ mol·L-1 | c(CO2)/ mol·L-1 | v(正)和v(逆) 比较 |
Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
Ⅱ | 5.0×10-4 | 4.0×10-4 | 6.0×10-2 | v(正)______v(逆) |
该温度下,2CO(g)+O2(g)![]() 2CO2(g)的平衡常数为____________
2CO2(g)的平衡常数为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是
A. 实验室可用浓硫酸干燥氨气
B. 陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
C. 漂白粉变质后的残留固体有碳酸钙
D. 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(T℃)下的溶液中,c(H+)=10﹣x molL﹣1 , c(OH﹣)=10﹣y molL﹣1 , x与y的关系如图所示,请回答下列问题: 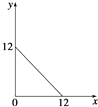
(1)此温度下,水的离子积Kw为 , 则该温度T25(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a= , 实验②中由水电离产生的c(OH﹣)=molL﹣1.
(3)在此温度下,将0.1molL﹣1的NaHSO4溶液与0.1molL﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1molL﹣1 Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1molL﹣1 NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显(填“酸”、“碱”或“中”)性.
②写出按乙方式混合后,反应的离子方程式: .
③按甲方式混合后,所得溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究H2O2制备氧气,生成氧气速率的影响因素,某同学设计了如下一系列实验。
实验编号 | 反应物 | 催化剂 |
甲 | 试管中加入3 mL 2% H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3 mL 5% H2O2溶液和3滴蒸馏水 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
丁 | 试管中加入3 mL 5% H2O2溶液和3滴稀盐酸溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
戊 | 试管中加入3 mL 5% H2O2溶液和3滴NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
[查阅资料] 过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定。在加热的条件下,它能分解生成氧气。研究表明,将新制的5%的H2O2溶液加热到65 ℃时就有氧气放出,加热到80 ℃时就有较多氧气产生。
(1)实验丙、实验丁和实验戊的实验目的是_____________________________________。
(2)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?______
(3)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验丁,20~40 s的反应速率v1=_____mL·s-1,100~120 s的反应速率v2=_____mL·s-1。不考虑实验测量误差,二者速率存在差异的主要原因是_____________________________________。
②如图是根据实验收集到最大体积的气体时所用时间绘制的图像。曲线c表示的是实验 ______(填“丙”“丁”或“戊”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com