


科目:高中化学 来源: 题型:
| A、浮在乙醇面上,融化成闪亮的小球 |
| B、沉到乙醇底部,融化成闪亮的小球 |
| C、沉到乙醇底部,缓慢产生气泡,钠不融化 |
| D、浮在乙醇面上,钠不融化但四处游动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、HCl的电子式: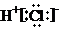 |
| B、C-12原子:12C |
| C、乙酸的结构简式:C2H4O2 |
| D、NH3?H2O的电离方程式:NH3?H2O→NH4++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
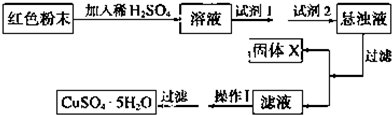
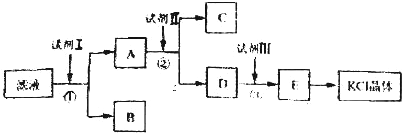
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:| 时间(s) n(mol) |
0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com