
【题目】锰及其化合物用途非常广泛,请回答下列问题:
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+ ,下列说法合理的是________
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+轨道内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[ Mn( CO)5( CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_________原子(填写元素名称),该分子中碳原子的杂化方式为___________。
(3)研究发现,在成甲醇反应(CO2 +3H2=CH3OH +H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为___________,原因是________________,硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在______,NO![]() 的空间构型是______________(用文字描述)。
的空间构型是______________(用文字描述)。
(4)某锰氧化物的晶胞结构如图所示,该锰氧化物的化学式为___________,该晶体中Mn的配位数是_______,该晶体中Mn之间的最近距离为_____cm(用含a、b的代数式表示)。
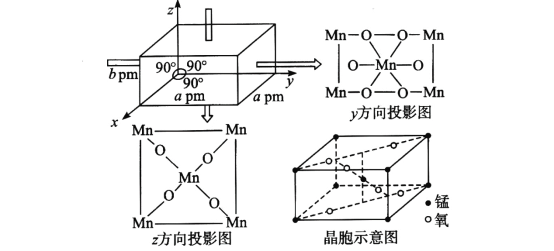
【答案】A N sp3和sp杂化 H2O>CH3OH>CO2>H2 H2O和CH3OH均为极性分子,H2O中氢键比CH3OH中多,CO2和H2均为非极性分子,CO2相对分子质量较大,范德华力较大 π键和离子键 平面三角形 MnO2 6 ![]()
![]()
【解析】
(1)根据Mn2+ 和Mn4+的结构分析;
(2)CH3CN分子中有3个CH键、1个CC键、1个C≡N键,只有N原子有1对孤电子对,分子中甲基中碳原子形成4个σ键、另一个碳原子形成2个σ键,都没有孤电子对,杂化轨道数目为4、2,碳原子采取sp3和sp杂化;
(3)水和甲醇分子间都存在氢键,二氧化碳和氢气常温下为气体,结合氢键数目和相对分子质量判断,用价层电子对互斥理论判断空间构型;
(4)用均摊法计算化学式,并结合微粒的空间排列确定Mn的配位数。由晶胞结构可知:在该晶胞中距离相等且最近的2个Mn在晶胞体对角线的一半。
(1)A.Mn3+在水溶液中容易歧化为MnO2和Mn2+,说明Mn3+不稳定,Mn3+容易变成电子半充满的稳定的价电子构型为3d5的Mn2+,3d4则属于不稳定的电子构型,故A正确;
B.Mn4+中价电子层不含成对电子,但是内层中含有成对电子,故B错误;
C.Mn2+内有大量自旋方向相同的电子,这些电子自旋方向相同,能够使原子的能量最低,而Mn2+易被氧化,显然与Mn2+内含有大量自旋方向相同的电子无关,故C错误;
D.Mn2+与Fe3+具有相同的价电子构型,微粒的化学性质不仅与价电子构型有关,也和微粒的电荷数、微粒半径、原子序数有关,因此它们的化学性质不相似,Mn2+具有强的还原性,而Fe3+具有较强的氧化性,故D错误;
答案选A;
(2) CH3CN分子中有3个CH键、1个CC键、1个C≡N键,只有N原子有1对孤电子对,提供孤对电子的原子是N原子;分子中甲基中碳原子形成4个σ键、另一个碳原子形成2个σ键,都没有孤电子对,杂化轨道数目为4、2,碳原子采取sp3和sp杂化;
(3)常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;H2O和CH3OH均为极性分子,H2O中氢键比CH3OH中多,CO2和H2均为非极性分子,CO2相对分子质量较大,范德华力较大,所以在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为H2O>CH3OH>CO2>H2;硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中氮原子和氧原子之间形成的有单键,双键,硝酸根和锰离子间形成离子建,故化学键除了σ键外,还含有π键和离子键;NO![]() 的中心原子是氮,价层电子对数是
的中心原子是氮,价层电子对数是![]() ,它的杂化方式为sp2杂化,NO
,它的杂化方式为sp2杂化,NO![]() 的空间构型是平面三角形;
的空间构型是平面三角形;
(4)在该晶体中含有的Mn原子个数为:![]() ×8+1=2,含有的O原子数目为
×8+1=2,含有的O原子数目为![]() ×4+2=4,Mn:O=2:4=1:2,所以该锰的氧化物的化学式为MnO2;根据晶胞投影图可知:在该晶体中与Mn原子距离相等且最近的O原子有6个,所以Mn的配位数为6;由晶胞结构可知:在该晶胞中距离相等且最近的2个Mn在晶胞体对角线的一半,晶胞的体对角线为
×4+2=4,Mn:O=2:4=1:2,所以该锰的氧化物的化学式为MnO2;根据晶胞投影图可知:在该晶体中与Mn原子距离相等且最近的O原子有6个,所以Mn的配位数为6;由晶胞结构可知:在该晶胞中距离相等且最近的2个Mn在晶胞体对角线的一半,晶胞的体对角线为![]() ,所以该晶体中Mn之间的最近距离为
,所以该晶体中Mn之间的最近距离为![]()
![]() =
=![]()
![]() cm。
cm。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,有质量相同的CO2、H2、O2、CH4、SO2五种气体,下列有关说法错误的是( )
A.气体的体积由大到小的顺序是H2>CH4>O2>CO2>SO2
B.所含分子数由多到少的顺序是H2>CH4>O2>CO2>SO2
C.密度由大到小的顺序是SO2>CO2>O2>CH4>H2
D.所含电子数由多到少的顺序是CO2>SO2>CH4>O2>H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于CO2+3H2![]() CH3OH+H2O,下列说法能判断该反应达到平衡状态的是
CH3OH+H2O,下列说法能判断该反应达到平衡状态的是
A. v(CO2)= ![]() v(H2) B. 3v逆(H2)=v 正(H2O)
v(H2) B. 3v逆(H2)=v 正(H2O)
C. v正(H2)=3v逆(CO2) D. 断裂 3molH-H 键的同时,形成 2molO-H 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺(C6H5-NHCOCH3)可用作止痛剂退热剂、防腐剂和染料中间体,常用苯胺(C6H5-NH2)与冰醋酸为原料制备,具体流程如下:
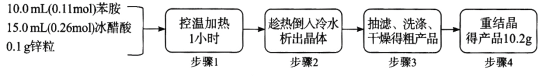
化学原理:C6H5-NH2 + CH3COOH![]() C6H5–NHCOCH3+ H2O,已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解;②部分物质有关性质如下表;③步骤1所用装置如图所示(固定装置、加热装置已略去)。
C6H5–NHCOCH3+ H2O,已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解;②部分物质有关性质如下表;③步骤1所用装置如图所示(固定装置、加热装置已略去)。


请回答下列问题:
(1)仪器a的名称________________________
(2)盛有冰醋酸的容器,最有可能贴有的安全标签是__________(填标号)。
a.  b.
b.  c.
c. d.
d. 
(3)加入锌粒,除了防止暴沸外,还能起到的作用是________________
(4)步骤1中控制温度计示数约105 °C的原因是_____________________
(5)判断反应基本完全的现象是____________;步骤3中洗涤乙酰苯胺粗产品最合适的试剂是_________(填标号)。
a.冰水 b.热水 c.15%的乙醇溶液 d. NaOH溶液
(6)步骤4中重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→ _____ →冷却结晶→过滤→洗涤→干燥。
(7)本实验中乙酰苯胺产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是( )
选项 | 实验操作 | 实验目的或结论 |
A | 向废FeCl3蚀刻液X中加入少量的铁粉,振荡,未出现红色固体 | X中一定不含Cu2+ |
B | 向AgCl悬浊液中滴入少量KI溶液,有黄色沉淀生成 | 说明Ksp(AgCl)>Ksp(AgI) |
C | 制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上 | 防止倒吸,便于分层 |
D | 向某溶液中滴加氯水,再滴加KSCN溶液,溶液变成红色 | 该溶液中一定含有Fe2+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:
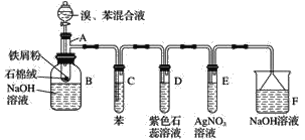
(1)写出A中主要反应的化学方程式:___________
(2)试管C中苯的作用是______________。反应开始后,观察试管D和试管E,看到的现象分别为D____________E____________。
(3)仪器B中的NaOH溶液的作用是____________,可观察到的现象是________。
(4)在上述整套装置中,具有防倒吸作用的装置有__________(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com