
| A、①② | B、②④ | C、①③ | D、②③④ |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
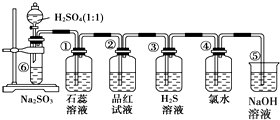 如图是实验室制备SO2并验证SO2某些性质的装置图,试回答:
如图是实验室制备SO2并验证SO2某些性质的装置图,试回答:| 装置 | 实验现象 | 体现SO2的性质 |
| ① | ||
| ② | ||
| ③ | ||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 使用氯化钠作原料可以得到多种产品.
使用氯化钠作原料可以得到多种产品.查看答案和解析>>
科目:高中化学 来源: 题型:
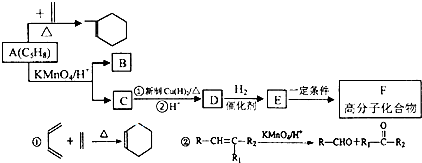
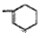 时,A发生的反应类型为
时,A发生的反应类型为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 |
B、基态Fe原子的外围电子排布图为: |
| C、因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 |
| D、根据原子核外电子排布的特点,Cu在周期表中属于s区元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4 mol.L-1 |
| B、0.2 mol.L-1 |
| C、0.3 mol.L-1 |
| D、0.05mol.L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com