
下列有关金属腐蚀与防护的说法正确的是( )
|
| A. | 纯银器表面在空气中因电化学腐蚀渐渐变暗 |
|
| B. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
|
| C. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
|
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
考点:
金属的电化学腐蚀与防护.
专题:
电化学专题.
分析:
A.纯银器主要发生化学腐蚀;
B.铁比锡活泼,易被腐蚀;
C.海轮外壳连接锌块,锌为负极;
D.防止金属被氧化,金属应连接电源的负极.
解答:
解:A.发生电化学腐蚀时,金属应不纯,则纯银器主要发生化学腐蚀,故A错误;
B.铁比锡活泼,当镀锡铁制品的镀层破损时,铁易被腐蚀,故B错误;
C.海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故C正确;
D.防止金属被氧化,金属应连接电源的负极,如连接正极,加剧腐蚀,故D错误.
故选C.
点评:
本题考查金属的腐蚀与防护,题目难度不大,注意把握金属腐蚀的原理和电化学知识.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
800℃时,在2L密闭容器中发生2NO(g)+O2(g)⇌2NO2(g),测得n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)用NO表示2s时该反应的平均速率v= mol•L﹣1•S﹣1
(2)写出该反应的平衡常数表达式:K= .
已知:K(800℃)>K(850℃),该反应是 (填“吸热”或“放热”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )
|
| A. | 氨水的电离作用大于氯化铵的水解作用 |
|
| B. | 氯化铵的水解作用大于氨水的电离作用 |
|
| C. | 氨水的存在抑制了氯化铵的水解 |
|
| D. | 氯化铵的存在抑制了氨水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
摩尔浓度相同的三种盐NaX、NaY和NaZ的溶液,其中pH值依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
|
| A. | HX、HZ、HY | B. | HZ、HY、HX | C. | HX、HY、HZ | D. | HY、HZ、HX |
查看答案和解析>>
科目:高中化学 来源: 题型:
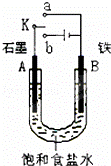
某课外活动小组同学用如图装置进行实验,试回答下列问题.
(1)若开始时开关K与a连接,则B极的电极反应式为 .有关该实验,下列说法正确的是(填序号) .
①A为正极,B为负极
②电子由电极B流出经溶液流向A极
③溶液中Na+向A极移动
④该反应相当于在模拟钢铁的析氢腐蚀
(2)若开关K与b连接,则可模拟工业上离子交换膜法制烧碱,该电池的总反应可表示为(离子方程式) .
有关该实验,下列说法正确的是(填序号) .
①B为阴极,发生氧化反应
②A极电极反应式可表示为2Cl﹣=Cl2↑+2e﹣
③溶液中Na+向A极移动
④若标准状况下B极产生2.24L气体,则电路中通过的电子数为0.2NA.
查看答案和解析>>
科目:高中化学 来源: 题型:
关于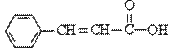 的下列说法中正确的是
的下列说法中正确的是
A.分子式为C9H9O2
B.含有三种官能团
C.可使溴的四氯化碳溶液或酸性KMnO4溶液褪色
D.可以发生取代反应和加成反应,但不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
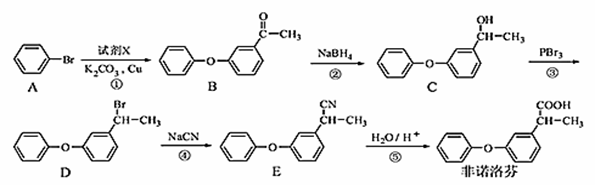
请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)化合物A的分子式为 。
(3)反应④的反应类型是 。
(4)化合物D与NaOH醇溶液反应的方程式 。
(5)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中含有两个苯环,且分子中有6种不同化学环境的氢。
写出该同分异构体的结构简式: 。
(6)利用类似上述非诺洛芬的合成方法,写出以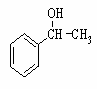 为原料制备
为原料制备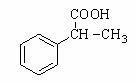 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
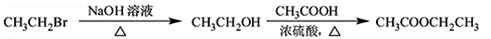
查看答案和解析>>
科目:高中化学 来源: 题型:
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡.请根据所学的知识回答:
(1)A为0.1mol/L的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 .
(2)B为0.1mol/L NaHCO3溶液,请分析NaHCO3溶液显碱性的原因,用离子方程式表示 .
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加 入 溶液以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com