
【题目】在25℃、101kPa条件下,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.7 kJ·mol-1能自发进行的原因是( )
A. 该反应是吸热反应B. 该反应是放热反应
C. 该反应是熵减小的反应D. 该反应的熵增效应大于能量效应
科目:高中化学 来源: 题型:
【题目】已知CeO2通常既不溶于强酸,也不溶于强碱。某工厂以平板电视显示屏厂的废玻璃粉末(含CeO2、SiO2、Fe2O3、FeO等物质)为原料,设计如下图所示工艺流程,制得纯净的CeO2。下列说法正确的是( )

A. 实验室中,操作3和操作1、操作2所用仪器不同
B. 滤渣中加入稀H2SO4和H2O2,其中H2O2做氧化剂
C. 滤液中Ce3+与NaOH、O2的反应属于化合反应
D. 操作2分离得到的滤渣中一定含有未反应的SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是(______)(填序号)。
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)下图是从海水中提取镁的简单流程。

①操作A是 _______________________。
②无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为_____。
③海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?____。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是(________)(填序号)。
a.坩埚 b.试管 c.蒸发皿 d.烧杯
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________________。
③用CCl4提取碘时除了用CCl4还可以选用的试剂是(________)(填字母序号)。
a.苯 b.乙醇 c.乙酸
④为检验用CCl4提取碘后的水溶液中是否还含有碘单质。请写出该实验的实验步骤、现象及结论:_______。
(4)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH = K2CO3+3H2O,则该燃料电池的负极的电极反应为__________________。
(5)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。
CH3OH(g)+H2O(g)。某科学实验将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。

①a点正反应速率_________(填“大于、等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是___________mol/L。
③能够说明该反应达到化学平衡状态的标志是_______(双选)。
A.单位时间内消耗1molCO2,同时生成3mol H2
B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化
D.CH3OH和H2O浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是
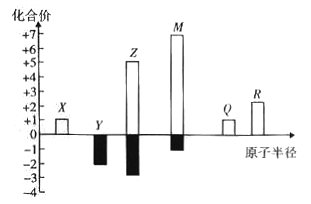
A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图)。下列说法错误的是
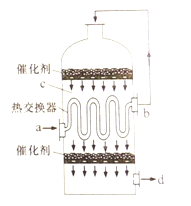
A. a、b两处的混合气体成分含量相同,温度不同
B. c、d两处的混合气体成分含量相同,温度不同
C. 热交换器的作用是预热待反应的气体,冷却反应后的气体
D. c处气体经热交换后再次催化氧化的目的是提高SO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有独立知识产权的电脑芯片“龙芯一号”的问世,填补了我国计算机制造史上的一项空白。下列对晶体硅的有关叙述正确的是
A.晶体硅的结构与金刚石类似
B.晶体硅的化学性质不活泼,常温下不与任何物质发生反应
C.晶体硅是一种良好的半导体材料,但是它提炼工艺复杂,价格昂贵
D.晶体硅具有金属光泽,故它属于金属材料,可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向乙酸、乙醇、乙酸乙酯和水的平衡体系中加入少量含有18O的![]() ,达到新平衡后,体系中含有18O的物质是
,达到新平衡后,体系中含有18O的物质是
A. 乙酸、乙醇 B. 乙醇、乙酸乙酯
C. 乙醇、乙酸乙酯和水 D. 乙酸、乙醇、乙酸乙酯和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为____________;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:_______________________;
(3)用电子式表示甲的形成过程:_____________________________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为________________;
(5)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有 H+、NH4+、Na+、Al3+、Fe3+、I-、NO3- 、CO32-、SO42- 、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③该溶液的焰色反应没有黄色;
④当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。
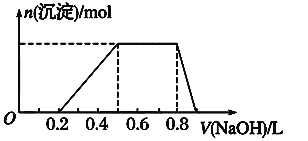
(1)该溶液中肯定含有的离子是_________________________,已确定阳离子的物质的量之比为_______________________。
(2)肯定不含的离子是_________________________________。
(3)不能确定的离子是_________,如何证明该离子是否存在?__________。
(4)请写出沉淀溶解过程的离子方程式____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com