
【题目】实验室常用如下装置所示方法制备氯气:
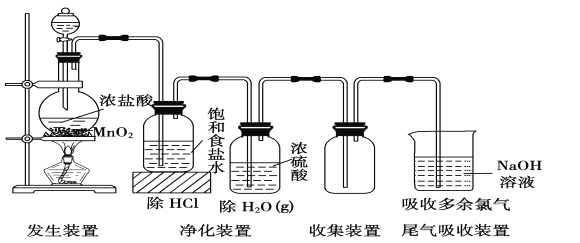
(1)1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,原因可能是_________________;
(2)若改用NaCl固体、浓硫酸和MnO2一起加热,理论上氯元素利用率可以达到100%,试用化学反应方程式表示原因____________________________________;
(3)若在分液漏斗下方接一段毛细管插入圆底烧瓶底部,不需加热也可获得均匀稳定干燥的氯化氢气流,则分液漏斗和圆底烧瓶中应该盛放的试剂分别是____________________________________。
【答案】浓盐酸挥发,稀盐酸不反应 2NaCl+2H2SO4+MnO2 MnSO4+Na2SO4+Cl2↑+2H2O 浓盐酸、浓硫酸
【解析】
(1)1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,浓盐酸易挥发,浓盐酸随着反应的进行会被稀释,当稀释到一定程度时就无法与氧化锰反应了,此时反应停止,故答案为:浓盐酸挥发,稀盐酸不反应。
(2)NaCl固体、浓硫酸和MnO2一起加热反应,反应的化学方程式为:2NaCl+2H2SO4+MnO2=MnSO4+Na2SO4+Cl2↑+2H2O,
故答案为:2NaCl+2H2SO4+MnO2=MnSO4+Na2SO4+Cl2↑+2H2O。
(3)浓HCl,本身就有挥发性,产生的是HCl气体,浓HCl挥发后变稀,由于浓硫酸有吸水性,稀HCl又变成浓HCl,所以加快了HCl的挥发速率,所以产生了均匀稳定干燥的氯化氢气流,所以分液漏斗和圆底烧瓶中应该盛放的试剂分别是浓盐酸、浓硫酸,故答案为:浓盐酸、浓硫酸。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】工业生产中,向Na2CO3溶液中通入SO2气体制备无水Na2SO3,水溶液中H2SO3、HSO3-、SO32-粒子的物质的量分数随pH的分布、Na2SO3的溶解度曲线如图所示:

下列说法不正确的是:
A. 溶液pH=4时,溶质为NaHSO3
B. 溶液pH=10时,c(Na+)+ c(H+)= c(OH–)+ c(SO32–)+ c(HSO3–)
C. 溶液pH=7时, c(SO32–)= c(HSO3–)
D. 溶液pH=10时,停止通入SO2,将溶液加热浓缩至有大量晶体析出,在高于34℃趁热过滤、洗涤、干燥得到无水Na2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOCCOOH,可简写为H2C2O4)。25℃时,草酸钙的Ksp=4.0×108,碳酸钙的Ksp=2.5×109。回答下列问题:
(1)25℃时向20mL碳酸钙的饱和溶液中逐滴加入8.0×104mol/L的草酸钾溶液20mL,能否产生沉淀________(填“能”或“不能”)。
(2)酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
I.实验前首先用浓度为0.1000molL1酸性KMnO4标准溶液滴定未知浓度的草酸。
①滴定过程中操作滴定管的图示正确的是________(填编号)。

②判断滴定终点的方法是:________。
③若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度__________(填“偏高”或“偏低”或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000molL1.用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
实验编号 | 温度 (℃) | 催化剂用量 (g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 | |
体积(mL) | 浓度(molL1) | ||||
1 | 25 | 0.5 | 4 | 0.1000 | |
b.实验1和3探究反应物浓度对该反应速率的影响;c.实验1和4探究催化剂对该反应速率的影响。 | |||||
2 | 50 | 0.5 | 4 | 0.1000 | |
3 | 25 | 0.5 | 4 | 0.0100 | |
4 | 25 | 0 | 4 | 0.1000 | |
④写出表中a对应的实验目的________;
⑤该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间(min) | ||
第1次 | 第2次 | 第3次 | |
1 | 14.0 | 13.0 | 11.0 |
3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的结构简式:![]() ,下列有关其几何结构的说法正确的是
,下列有关其几何结构的说法正确的是
A. 所有碳原子不可能在同一平面上 B. 有4个碳原子在同一直线上
C. 有5个碳原子在同一直线上 D. 有6个碳原子在同一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A. Na的还原性强于金刚石B. 另一种化合物是NaCl
C. 纳米级金刚石粉末可以透过半透膜D. 这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.3 molMnO2和100mL 12 mol/L的浓盐酸混合后缓慢加热,充分反应后向留下的溶液中加入足量的AgNO3溶液,生成AgCl沉淀的物质的量为(不考虑HCl的挥发)( )
A. 等于0.6molB. 小于0.6mol
C. 大于0.6mol,小于1.2molD. 以上结论都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题 )M结构简式如图所示,是牙科粘合剂,X是高分子金属离子螯合剂,以下是两种物质的合成路线:


已知:I.A为烯烃,C属于环氧类物质,G分子中只有1种氢原子
II.
III.
IV.R1CHO+R2NH2![]() R1CH=NH2+H2O
R1CH=NH2+H2O
(1)A→B的反应类型是_________,C→D的可采用的反应条件是____________。
(2)下列说法正确的是______。
A.B中含有的官能团是碳碳双键和氯原子
B.J可与Na2CO3溶液反应,1 mol J与饱和溴水反应最多消耗4mol Br2
C.在一定条件下,F可以发生缩聚反应
D.X可发生加成、氧化和消去反应
(3)Q+Y→X的化学方程式是_________________________________________。
(4)请设计以甲苯和A作为原料制备 的合成路线流程图(无机试剂任用)____________________________。
的合成路线流程图(无机试剂任用)____________________________。
(5)写出符合下列条件的K的同分异构体:____________________________
①能发生银镜反应,不能发生水解反应;
②含有五元碳环,核磁共振氢谱有5组峰;
③结构中无-C=C-OH和-O-O-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 1mol N2, 右边充入 CO 和 CO2 的混合气体共 8g 时,隔板处于如图位置(保持温度不变),下列说法正确的是

A. 右边 CO 与 CO2 分子数之比为 1:3
B. 右侧 CO 的质量为 2.75g
C. 若改变右边 CO 和 CO2 的充入量而使隔板处于离右端1/6处, 保持温度不变,则前后两次充入容器内的气体压强之比为 5: 3
D. 右侧气体密度是相同条件下氢气密度的 16 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物AB,A离子核外有10个电子,B离子的L层电子数比其K层与M层电子数之和少2个电子,则AB的化学式为( )
A.NaFB.NaClC.KClD.MgO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com