
| A、低温下自发进行,高温下非自发进行 |
| B、任何温度下均为自发进行 |
| C、任何温度下均为非自发进行 |
| D、高温下自发进行,低温下非自发进行 |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、蛋白质中只含C、H、O三种元素 |
| B、油脂在人体中发生水解的产物是氨基酸 |
| C、糖类的主要成分是高级脂肪酸甘油酯 |
| D、油脂、蛋白质都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释溶液,水解平衡常数增大 | ||||||
B、升高温度,
| ||||||
| C、通入CO2,平衡右移动 | ||||||
| D、加入NaOH(s),溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| B、Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C、pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
| D、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的电离方程式:H2O═H++OH- |
| B、升高温度,水的电离程度增大 |
| C、在NaOH溶液中没有H+,在HCl溶液中没有OH- |
| D、纯水中c(H+)=10-7 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有气体参加的化学反应,若增大压强,可增加活化分子的百分数,从而使反应速率增大 |
| B、催化剂不参与反应,但能降低活化能增大活化分子的百分数,从而增大反应速率 |
| C、增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多 |
| D、升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
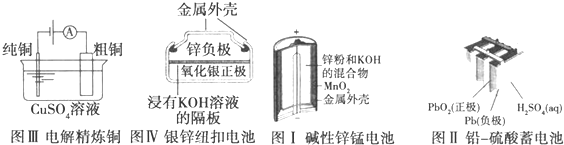
| A、图Ⅰ所示电池中,MnO2作催化剂 |
| B、图Ⅱ所示电池放电过程中,硫酸浓度不断增大 |
| C、图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变 |
| D、图Ⅳ所示电池中,Ag2O作氧化剂,在电池工作过程中被还原为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
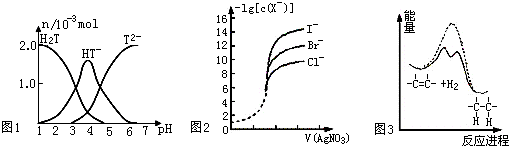
| A、常温下,向20mL0.1mol?L-1酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液.有关微粒的物质的量与混合溶液的pH有如图1,则当VNaOH=10mL时,溶液中存在2C(Na+)=C(H2T)+C(HT-)+C(T2-) | ||
| B、用0.0100mol?L-1硝酸银标准溶液,滴定浓度均为0.100mol?L-1的 Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | ||
C、已知25℃、101kPa时:①2Na(s)+
| ||
| D、由图3可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com