
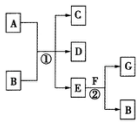
 如图,图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体.请据图回答下列问题:
如图,图中,反应①为常温下的反应,A、C、D中均含有氯元素,且A中氯元素的化合价介于C和D中氯元素的化合价之间,E在常温下为无色无味的液体,F是淡黄色固体,G为常见的无色气体.请据图回答下列问题:分析 E常温下为无色无味的液体,应为H2O,F为淡黄色粉末,应为Na2O2,则G为O2,B为NaOH,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,应为Cl2和NaOH的反应,生成NaCl和NaClO,结合物质的性质结合该题.
解答 解:(1)由以上分析可知A为Cl2,G为O2,故答案为:Cl2、O2;
(2)氯气和铁反应生成氯化铁,反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故答案为:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
(3)反应②为过氧化钠和水的反应,方程式为2Na2O2+2H2O=4 NaOH+O2↑,故答案为:2Na2O2+2H2O=4 NaOH+O2↑;
(4)①氯气和水反应生成盐酸和次氯酸,发生Cl2+H2O?HCl+HClO,盐酸具有酸性,可使紫色石蕊试液变红,生成的次氯酸具有漂白性,可使溶液褪色,
故答案为:紫色试液先变红后褪色;Cl2+H2O?HCl+HClO;
②氯气和氢氧化钙反应生成漂白粉,有效成分为Ca(ClO)2,在空气中与二氧化碳、水反应生成不稳定的次氯酸,次氯酸见光分解,涉及反应为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO═2HCl+O2↑,
故答案为:Ca(ClO)2;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、2HClO═2HCl+O2↑.
点评 本题考查无机物的推断,为高考常见题型和高频考点,侧重考查学生的分析能力,题目难度不大,本题的突破口在于物质的颜色和状态,注意常温下氯气与碱反应生成次氯酸盐.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源:2016-2017学年河北省高一上第一次月考化学试卷(解析版) 题型:选择题
同温同压下,用等质量的H2、CH4、CO2、HCl四种气体分别吹起四个气球,其中是由CO2吹起的是( )
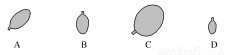
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R一定是共价化合物 | |
| B. | R一定是离子化合物 | |
| C. | R可能是共价化合物,也可能是离子化合物 | |
| D. | R常温下一定是固态物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
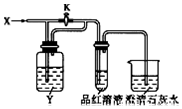 向如图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是( )
向如图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是( )| A | B | C | D | |
| X | C12 | NO2 | HCl | SO2 |
| Y | Na2SO3溶液 | 水 | Na2SO3溶液 | 饱和NaHCO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 | ① | ② | ③ | ④ | ⑤[ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.18 |
| 最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负化合价 | -2 | -3 | -1 | -3 |
| A. | 元素①⑧形成的化合物具有两性 | |
| B. | 元素⑦位于第二周期Ⅴ族 | |
| C. | 元素④⑤形成的化合物是离子化合物 | |
| D. | 元素⑥的最高价氧化物对应水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
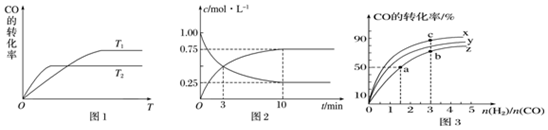
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
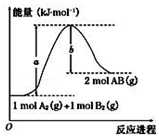
| A. | 每生成 2 个分子 AB 吸收(a-b) kJ 热量 | |
| B. | 该反应热△H=+(a-b)kJ•mol-1 | |
| C. | 逆反应的活化能高于正反应的活化能 | |
| D. | 断裂1mol A-A 和 1mol B-B 键,放出 a kJ 能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com