
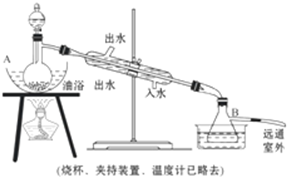
分析 (1)乙醇含-OH,乙酸含-COOH;
(2)酯化反应为可逆反应,且浓硫酸具有吸水性;
(3)过量乙醇,可促进乙酸的转化;
(4)加热油浴保持温度约135℃~145℃,温度恒定;
(5)乙酸与乙醇发生酯化反应生成乙酸乙酯和水,醇脱H,羧酸脱羟基;
(6)饱和碳酸钠溶液可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,乙酸乙酯与碳酸钠溶液分层;乙酸乙酯与NaOH发生水解反应.
解答 解:(1)乙醇和乙酸中所含官能团的名称分别为羟基和羧基,故答案为:羟基;羧基;
(2)实验中浓硫酸的主要作用是催化剂、吸水剂,故答案为:催化剂、吸水剂;
(3)用过量乙醇的主要目的是促进乙酸转化,利用合成乙酸乙酯,故答案为:促进乙酸转化,利用合成乙酸乙酯;
(4)实验中用油浴加热的优点是保持温度恒定,故答案为:保持温度恒定;
(5)制取乙酸乙酯的反应类型是酯化反应,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:酯化;CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(6)用饱和Na2CO3溶液洗涤粗酯的目的是吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度.如果用NaOH浓溶液代替Na2CO3溶液将引起的后果是酯发生水解,
故答案为:吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;酯发生水解.
点评 本题考查有机物的制备实验,为高频考点,把握物质的制备原理、性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
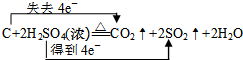 .
.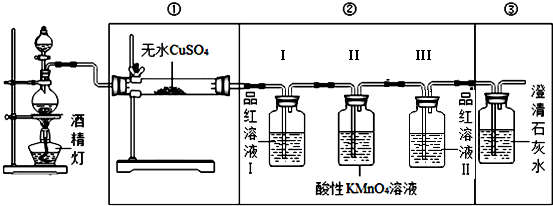
| 实验装置 | ① | ③ |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
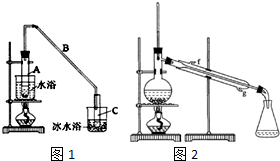 某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.
某化学小组采用类似乙酸乙酯的装置如图1:以环己醇制备环己烯.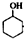 $→_{85℃}^{稀H_{2}SO_{4}}$
$→_{85℃}^{稀H_{2}SO_{4}}$ +H2O
+H2O| 密度(g.cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.096 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.081 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
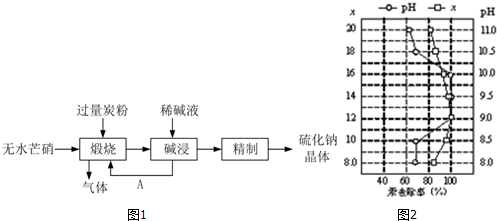
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
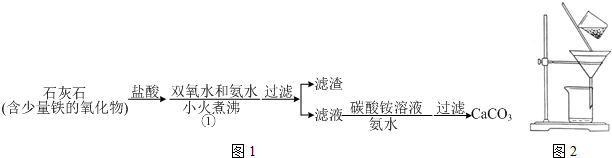
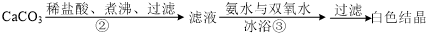
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO2 (g)?N2O4(g)△H<0 | B. | C(s)+CO2 (g)?2CO(g)△H>0 | ||
| C. | N2(g)+3H2 (g)?2NH3(g)△H<0 | D. | H2S (g)?H2 (g)+S(s)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
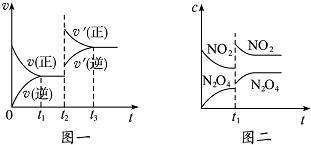
| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
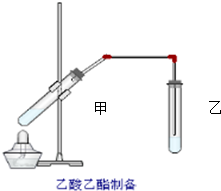 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com