
分析 (1)0.1mol/LNaHB溶液pH=1,氢离子浓度为0.1mol/L,说明NaHB在溶液中完全电离出氢离子;稀释后氢离子浓度为0.01mol/L,然后根据稀释定律计算出加入水的体积;
(2)25℃时此溶液和某浓度氨水pH之和为14,氨水的pH=14-1=13,由于氨水为弱碱,二者等体积混合后氨水过量,溶液呈碱性,则:c(OH-)>c(H+),据此判断各离子浓度大小.
解答 解:(1)0.1mol/LNaHB溶液pH=1,氢离子浓度为0.1mol/L,说明NaHB在溶液中完全电离出氢离子,
若向该溶液中加V1 mL水,使溶液pH变为2,氢离子浓度为0.01mol/L,
稀释过程中氢离子的物质的量不变,则满足:0.1mol/L×0.1L=0.01mol/L×(0.1L+V1×10-3L),
解得:V1=900mL,
故答案为:900;
(2)25℃时此溶液和某浓度氨水pH之和为14,氨水的pH=14-1=13,由于氨水为弱碱,二者等体积混合后氨水过量,溶液呈碱性,则c(OH-)>c(H+),根据物料守恒可得c(Na+)=c(B2-),反应后溶质离子浓度大小为:c(NH4+)>c(Na+)=c(B2-)>c(OH-)>c(H+),
故答案为:c(NH4+)>c(Na+)=c(B2-)>c(OH-)>c(H+).
点评 本题考查了溶液pH计算、离子浓度大小比较,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的计算方法,试题培养了学生学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、SO42-、Na+、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | H+、I-、Cl-、NO3- | D. | K+、SO42-、Mg2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有白色沉淀生成 | |
| B. | 有红棕色沉淀生成 | |
| C. | 没有沉淀生成 | |
| D. | 既有红褐色沉淀生成又有无色气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
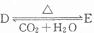 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com