
”¾ĢāÄæ”æŅŃÖŖA”¢B”¢C”¢DŹĒŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄĖÄÖÖ¶ĢÖÜĘŚÖ÷×åŌŖĖŲ£¬AµÄÖÜĘŚŹżµČÓŚĘäÖ÷×åŠņŹż£¬BŌ×ӵļŪµē×ÓÅŲ¼ĪŖnsnnpn£¬DŹĒµŲæĒÖŠŗ¬Įæ×ī¶ąµÄŌŖĖŲ”£EŹĒµŚĖÄÖÜĘŚŌŖĖŲĒŅ×īĶā²ćÖ»ÓŠ2¶Ō³É¶Ōµē×Ó£¬FŌŖĖŲÓėCrŌŖĖŲĪ»ÓŚĶ¬Ņ»ÖÜĘŚµÄø±×åŌŖĖŲÖŠĒŅ»łĢ¬Ō×ÓµÄ×īĶā²ćµē×ÓŹżÓėCrŌ×ÓĻąĶ¬”£
£Ø1£©B”¢C”¢DČżŌŖĖŲµŚŅ»µēĄėÄÜÓɓ󵽊”µÄĖ³ŠņĪŖ £ØÓĆŌŖĖŲ·ūŗűķŹ¾£©
£Ø2£©BD32-ÖŠŠÄŌ×ÓŌӻƹģµĄµÄĄąŠĶĪŖ________Ōӻƣ»CA4+µÄæռ乹ŠĶĪŖ______________”£
£Ø3£©»łĢ¬EŌ×ӵļŪµē×ÓÅŲ¼Ķ¼______________________________”£
£Ø4£©1mol BC£ÖŠŗ¬ÓŠ¦Š¼üµÄŹżÄæĪŖ______________”£
£Ø5±Č½ĻD”¢EŌŖĖŲ×ī¼ņµ„Ēā»ÆĪļµÄ·ŠµćøßµĶ£ŗ £ØÓĆ»ÆѧŹ½±ķŹ¾£©”£
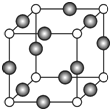
£Ø6£©C”¢FĮ½ŌŖĖŲŠĪ³ÉµÄij»ÆŗĻĪļµÄ¾§°ū½į¹¹ČēĶ¼ĖłŹ¾£¬¶„µćĪŖCŌ×Ó”£ŌņøĆ»ÆŗĻĪļµÄ»ÆѧŹ½ŹĒ £¬CŌ×ÓµÄÅäĪ»ŹżŹĒ ”£ČōĻąĮŚCŌ×ÓŗĶFŌ×Ó¼äµÄ¾ąĄėĪŖa cm£¬°¢·üŁ¤µĀĀŽ³£ŹżĪŖNA£¬ŌņøĆ¾§ĢåµÄĆܶČĪŖ________________g£Æcm3£ØÓĆŗ¬a”¢NAµÄ·ūŗűķŹ¾£©”£
”¾“š°ø”æ£Ø1£©N£¾O£¾C £Ø2£©sp2 ÕżĖÄĆęĢå £Ø3£©![]() £Ø4£©2NA
£Ø4£©2NA
£Ø5£©H2O£¾H2Se £Ø6£©Cu3N 6 ![]()
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗAµÄÖÜĘŚŹżµČÓŚĘäÖ÷×åŠņŹż£¬Ó¦ĪŖHŌŖĖŲ£¬BŌ×ӵļŪµē×ÓÅŲ¼ĪŖnsnnpn£¬n=2£¬Ó¦ĪŖCŌŖĖŲ£¬DŹĒµŲæĒÖŠŗ¬Įæ×ī¶ąµÄŌŖĖŲ£¬Ó¦ĪŖOŌŖĖŲ£¬ŌņCĪŖNŌŖĖŲ£¬EŹĒµŚĖÄÖÜĘŚµÄpĒųŌŖĖŲĒŅ×īĶā²ćÖ»ÓŠ2¶Ō³É¶Ōµē×Ó£¬Ó¦ĪŖSeŌŖĖŲ£¬FŌŖĖŲµÄ»łĢ¬Ō×ÓµŚĖÄÄܲćÖ»ÓŠŅ»øöµē×Ó£¬ĘäĖüÄÜ²ć¾łŅŃ³äĀśµē×Ó£¬ĪŖCuŌŖĖŲ£»
£Ø1£©Ķ¬ÖÜĘŚŌŖĖŲ“Ó×óµ½ÓÉŌŖĖŲµÄµŚŅ»µēĄėÄÜÖš½„Ōö“ó£¬ÓÉÓŚOŌ×ÓŗĖĶā¼Ūµē×ÓÅŲ¼Ź½2s22p4£¬¶ųNŌ×ÓŗĖĶā¼Ūµē×ÓÅŲ¼Ź½2s22p3£¬2pŃĒ²ćŹōÓŚ°ė³äĀśµÄĪČ¶Ø½į¹¹£¬ÄŃŹ§Č„Ņ»øöµē×Ó£¬Ņņ“ĖµŚŅ»µēĄėÄܽĻ“óµÄĪŖNŌŖĖŲ£¬ŌņĖ³ŠņĪŖN£¾O£¾C£»
£Ø2£©CO32-ÖŠŠÄŌ×ÓŠĪ³É3øö¦Ņ¼ü£¬¹Āµē×Ó¶ŌŹżĪŖ![]() =0£¬ŌӻƹģµĄµÄĄąŠĶĪŖsp2£¬NH4+ÖŠŠÄŌ×ÓŠĪ³É4øö¦Ņ¼ü£¬æռ乹ŠĶĪŖÕżĖÄĆęĢ壻
=0£¬ŌӻƹģµĄµÄĄąŠĶĪŖsp2£¬NH4+ÖŠŠÄŌ×ÓŠĪ³É4øö¦Ņ¼ü£¬æռ乹ŠĶĪŖÕżĖÄĆęĢ壻
£Ø3£©ÓÉŅŌÉĻ·ÖĪöæÉÖŖEĪŖSeŌŖĖŲ£¬×īĶā²ćÓŠ6øöµē×Ó£¬¼Ūµē×ÓÅŲ¼Ķ¼ĪŖ![]() £»
£»
£Ø4£©CN-ÓėN2ĪŖµČµē×ÓĢ壬ŗ¬ÓŠC”ŌN¼ü£¬Ōņ1mol BC-ÖŠŗ¬ÓŠ¦Š¼üµÄŹżÄæĪŖ2NA£»
£Ø5£©·Ē½šŹōŠŌO£¾S£¬ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬¼üÄÜŌ½“󣬶ŌÓ¦µÄĒā»ÆĪļŌ½ĪČ¶Ø£¬ŌņH2O£¾H2Se£»
£Ø6£©Óɾ§°ū½į¹¹æÉÖŖ£¬NŌ×ÓĪ»ÓŚ¶Øµć£¬øöŹżĪŖ8”Į=1£¬CuĪ»ÓŚĄā£¬øöŹżĪŖ12”Į=3£¬Ōņ»ÆѧŹ½ĪŖCu3N£¬¾§°ūÖŠĪ»ÓŚ¶ØµćŗĶĄāŠÄµÄĪ»ÖĆ×ī½ü£¬ŌņNŌ×ÓµÄÅäĪ»ŹżŹĒ6£¬ČōĻąĮŚCŌ×ÓŗĶFŌ×Ó¼äµÄ¾ąĄėĪŖa cm£¬Ōņ±ß³¤ĪŖ2acm£¬¾§°ūµÄĢå»żĪŖ8a3cm3£¬¾§°ūµÄÖŹĮæĪŖ![]() g£¬ŌņĆܶČĪŖ
g£¬ŌņĆܶČĪŖ![]() g/cm3=
g/cm3=![]() g/cm3ӣ
g/cm3ӣ


 ĢģĢģĻņÉĻæŚĖć±¾ĻµĮŠ“š°ø
ĢģĢģĻņÉĻæŚĖć±¾ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø £©
A. µ°°×ÖŹĖ®½āÉś³É°±»łĖį
B. ĢĒĄą”¢ÓĶÖ¬”¢µ°°×ÖŹ¾łŹōÓŚøß·Ö×Ó»ÆŗĻĪļ
C. ĘĻĢŃĢĒ”¢ÕįĢĒ¶¼ŹōÓŚµ„ĢĒ
D. ĄūÓĆÓĶÖ¬ŌŚĖįŠŌĢõ¼žĻĀĖ®½āÖĘČ”·ŹŌķ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®2”Ŗ¼×»ł±ūĶéµÄ°ĖĀČČ”“śĪļÓŠČżÖÖ
B£®![]() »„ĪŖĶ¬ĻµĪļ
»„ĪŖĶ¬ĻµĪļ
C£®Ė³”Ŗ2”Ŗ¶”Ļ©Óė·“”Ŗ2”Ŗ¶”Ļ©ÓėĒāĘų¼Ó³ÉµÄ²śĪļ²»ĻąĶ¬
D£®![]() µÄĆū³ĘĪŖ2”Ŗ¼×»ł”Ŗ3”ŖŅŅ»ł¶”Ķé
µÄĆū³ĘĪŖ2”Ŗ¼×»ł”Ŗ3”ŖŅŅ»ł¶”Ķé
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲĆŗ”¢ŹÆÓĶ”¢ĢģČ»ĘųµČ׏Ō“µÄĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. ŹÆÓĶĮŃ½āµĆµ½µÄĘūÓĶŹĒ“æ¾»Īļ
B. ĆŗµÄĘų»Æ¾ĶŹĒ½«ĆŗŌŚøßĪĀĢõ¼žÓɹĢĢ¬×Ŗ»ÆĪŖĘųĢ¬£¬ŹĒĪļĄķ±ä»Æ¹ż³Ģ
C. ĢģČ»ĘųŹĒŅ»ÖÖĒå½ąµÄ»ÆŹÆČ¼ĮĻ
D. Ćŗ¾ĶŹĒĢ¼£¬ŹōÓŚµ„ÖŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®ÅŻÄĆš»šĘ÷µÄĆš»šŌĄķŹĒĮņĖįĀĮÓėĖÕ“ņČÜŅŗ·¢Éś·“Ó¦
B£®Ź³ÓĆÓĶ·“ø“¼ÓČČ»į²śÉś³ķ»··¼ĢžµČÓŠŗ¦ĪļÖŹ
C£®ÓĆFeCl3øÆŹ“Ó”Ė¢µēĀ·°åŹĒŅņĪŖĢśµÄ½šŹōŠŌĒæÓŚĶ
D£®¹¤Ņµ¾Ę¾«ÅضČøßÓŚŅ½ÓĆ¾Ę¾«£¬ĖłŅŌĘäĻū¶¾ÄÜĮ¦øüĒæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A£®NaHSO4ŌŚČŪȌדĢ¬ĻĀµÄµēĄė·½³ĢŹ½ĪŖNaHSO4ØTNa++H++SO42©
B£®H2CO3ŹĒČõĖį£¬¹ŹNa2CO3ŹĒČõµē½āÖŹ
C£®KClO3ŗĶSO3ČÜÓŚĖ®ŗóÄܵ¼µē£¬¹ŹKClO3ŗĶSO3ĪŖµē½āÖŹ
D£®NaHCO3ŌŚĖ®ČÜŅŗÖŠµÄµēĄė£ŗNaHCO3ØTNa++HCO3©”¢HCO3©![]() H++CO32©
H++CO32©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦ÖŠ£¬¹āÕÕ¶Ō·“Ó¦¼øŗõƻӊӰĻģµÄŹĒ£Ø £©
A. ĀČĘųÓėĒāĘųµÄ·“Ó¦
B. ĀČĘųÓė¼×ĶéµÄ·“Ó¦
C£®ŃõĘųÓė¼×ĶéµÄ·“Ó¦
D. “ĪĀČĖįµÄ·Ö½ā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ3-¼×»łĪģĶéµÄŅ»ĀČ“ś²śĪļÓŠ(²»æ¼ĀĒĮ¢ĢåŅģ¹¹)( )
A. 3ÖÖ B. 4ÖÖ C. 5ÖÖ D. 6ÖÖ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»īŠŌĢææÉ“¦Ąķ“óĘųĪŪČ¾ĪļNO”£T”ꏱ£¬ŌŚ1LĆܱÕČŻĘ÷ÖŠ¼ÓČėNOĘųĢåŗĶĢæ·Ū£¬·¢Éś·“Ӧɜ³ÉĮ½ÖÖĘųĢåAŗĶB£¬²āµĆø÷ĪļÖŹµÄĪļÖŹµÄĮæČēĻĀ£ŗ
»īŠŌĢæ/mol | NO/mol | A/mol | B/mol | |
ĘšŹ¼×“Ģ¬ | 2.030 | 0.100 | 0 | 0 |
2 minŹ± | 2.000 | 0.040 | 0.030 | 0.030 |
£Ø1£©2 minÄŚ£¬ÓĆNO±ķŹ¾øĆ·“Ó¦µÄĘ½¾łĖŁĀŹv(NO)£½ mol”¤L-1”¤min-1£»
£Ø2£©øĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ________________________________________£»
£Ø3£©Ņ»¶ØĢõ¼žĻĀ£¬ŌŚĆܱÕŗćČŻµÄČŻĘ÷ÖŠ£¬ÄܱķŹ¾ÉĻŹö·“Ó¦“ļµ½»ÆŃ§Ę½ŗāדĢ¬µÄŹĒ_____ ”£
¢Łv(NO)”Ćv(A)”Ćv(B)=2”Ć1”Ć1
¢Ś»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁøıä
¢Ū×ÜŃ¹Ēæ²»ŌŁøıä
¢Ü»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁøıä
£Ø4£©Ģ¼ŌŖĖŲæÉŠĪ³ÉŹżĮæÖŚ¶ą£¬·Ö²¼¼«¹ćµÄÓŠ»ś»ÆŗĻĪļ£¬ĘäÖŠ¼×“¼ŹĒ³£¼ūµÄČ¼ĮĻ£¬¼×“¼Č¼ĮĻµē³ŲµÄ½į¹¹Ź¾ŅāĶ¼ČēĻĀ£¬Ņ»¼«ĶØČė¼×“¼£¬ĮķĶāŅ»¼«ĶØČėŃõĘų£»µē½āÖŹČÜŅŗŹĒĻ”ĮņĖį£¬µē³Ų¹¤×÷Ź±×Ü·“Ó¦Ź½£ŗ2CH3OH£«3O2£½2CO2£«4H2O”£

¢Ła“¦ĶØČėµÄĪļÖŹŹĒ____£¬µē¼«·“Ó¦Ź½ĪŖ£ŗ______£»
¢Śb“¦µē¼«·“Ó¦Ź½ĪŖ_________________________£»
¢Ūµē³Ų¹¤×÷Ź±H£«ÓÉ ¼«ŅĘĻņ ¼«£ØĢīÕż”¢øŗ¼«£©”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com