
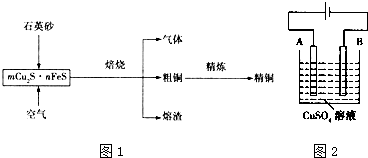
分析 石英砂主要成分为二氧化硅,加入冰铜(mCu2S•nFeS)中焙烧,生成Cu2O、Cu,生成气体为二氧化硫,熔渣为FeSiO3等,粗铜电解精炼可得到精铜.
(1)石英砂的主要成分是二氧化硅,二氧化硅和氧化亚铁反应生成硅酸亚铁;
(2)由流程图转化可知,气体中的大气污染物主要是二氧化硫,二氧化硫是制取硫酸的原料气,选择试剂吸收二氧化硫,不能产生新的污染气体,二氧化硫是酸性氧化物,结合选项中各物质的性质判断;
(3)Cu2S被氧化成Cu2O和二氧化硫气体,生成的Cu2O与Cu2S反应生成铜和二氧化硫;
(4)依据粗铜精炼原理分析,粗铜做阳极,精铜做阴极,由A极为阳极,故铁先放电,铜后放电,依据电极方程式的书写规则写出即可;
(5)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,正极上是氧气得到电子发生还原反应,酸性溶液中生成的氢氧根离子以水的形式存在.
解答 解:石英砂主要成分为二氧化硅,加入冰铜(mCu2S•nFeS)中焙烧,生成Cu2O、Cu,生成气体为二氧化硫,熔渣为FeSiO3等,粗铜电解精炼可得到精铜.
(1)石英砂的主要成分是二氧化硅(SiO2),二氧化硅和氧化亚铁反应:SiO2+FeO$\frac{\underline{\;高温\;}}{\;}$FeSiO3,所以熔渣的主要成分为硅酸亚铁;
故答案为:SiO2;FeSiO3;
(2)由流程图转化可知,气体中的大气污染物主要是二氧化硫,二氧化硫是制取硫酸的原料气,回收该气体选择试剂吸收二氧化硫,不能产生新的污染气体,
a、浓H2SO4不能吸收二氧化硫,故a错误;
b、浓HNO3可以吸收二氧化硫,但生成NO2污染大气,故b错误;
c、氨水与二氧化硫反应生成亚硫酸铵,故c正确;
故答案为:硫酸;c;
(3)Cu2S被氧化成Cu2O和二氧化硫气体,反应的方程式为2Cu2S+3O2$\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2,生成的Cu2O与Cu2S反应生成铜和二氧化硫,反应的方程式为2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2,
故答案为:2Cu2S+3O2$\frac{\underline{\;高温\;}}{\;}$2Cu2O+2SO2;2Cu2O+Cu2S$\frac{\underline{\;高温\;}}{\;}$6Cu+SO2;
(4)粗铜中含有Fe、Ag、Pt、Au等杂质,电解一段时间后,其中的铁失电子生成亚铁离子,铜失电子生成铜离子,所以A极反应为:Fe-2e-=Fe2+,Cu-2e-=Cu2+;
故答案为:粗铜;Fe-2e-=Fe2+,Cu-2e-=Cu2+;
(5)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O,
故答案为:4H++O2+4e-═2H2O.
点评 本题考查了由冰铜继续冶炼铜的有关知识,侧重考查铜及其化合物的性质、电解原理的分析应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol NaOH中含有的阴离子数目为0.1NA | |
| B. | 1 L0.05mol?L-1 CH3 COOH溶液中含有的H+数目为0.05NA | |
| C. | 标准状况下,44.8 LCCl4含有的分子数为2NA | |
| D. | 反应:ClO3-+5Cl-+6H+=3Cl2+3H2O中,每生成1mol Cl2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
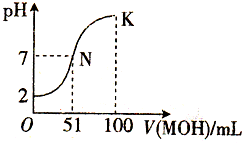 在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )
在常温下,向100mL 0.01mol/L HA溶液中逐滴加入0.02mol/L MOH溶液,混合溶液的pH变化情况如图中所示曲线(体积变化忽略不计).下列叙述正确的是( )| A. | MA溶液的pH>7 | B. | K点时加水稀释溶液,c(H+)减小 | ||
| C. | 在N点,c(A-)=c(M+)+c(MOH) | D. | 在K点,c(M+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.
利用2Al+2NaOH+2H2O=2NaAlO2+3H2反应,设计一个原电池.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
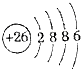
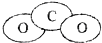
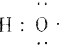 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同

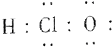
| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5) | D. | (1)(2)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:验证苯中是否有碳碳双键 | |
| B. | 图2:验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 图3:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 图4:验证酸性CH3COOH>H2CO3>C6H5OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com