
| A.0.2 mol | B.0.3mol |
| C.0.4 mol | D.0.6 mol |
 2Cu↓+O2↑+2H2SO4,第二阶段:2H2O
2Cu↓+O2↑+2H2SO4,第二阶段:2H2O 2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuO?H2O?CO2,所以加入0.05molCu2(OH)2CO3 就相当于加入0.1molCuO和0.05mol水,第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.1mol,转移电子的物质的量=0.1mol×2=0.2mol;第二阶段:电解生成0.05mol水转移电子的物质的量=0.05mol×2=0.1mol,所以解过程中共转移的电子数为0.2mol+0.1mol=0.3mol,答案选B。
2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuO?H2O?CO2,所以加入0.05molCu2(OH)2CO3 就相当于加入0.1molCuO和0.05mol水,第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.1mol,转移电子的物质的量=0.1mol×2=0.2mol;第二阶段:电解生成0.05mol水转移电子的物质的量=0.05mol×2=0.1mol,所以解过程中共转移的电子数为0.2mol+0.1mol=0.3mol,答案选B。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:不详 题型:单选题

| A.储存H2的碳纳米管放电时为负极,充电时为阳极 |
| B.充电时阳极反应为NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣ |
| C.放电时正极附近溶液的pH减小 |
| D.放电时负极反应为H2+2OH﹣﹣2e﹣=2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2CH3OH+3O2 2CO2+4H2O 2CO2+4H2O |
| B.NaOH+HCl = NaCl+H2O |
| C.Zn+2HCl = ZnCl2+H2↑ |
| D.4Al+3O2+6H2O = 4Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.图Ⅰ中a为纯铜 |
| B.图Ⅰ中SO42-向b极移动 |
| C.图Ⅱ中如果a、b间连接电源,则a连接负极 |
| D.图Ⅱ中如果a、b间用导线连接,则X可以是铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
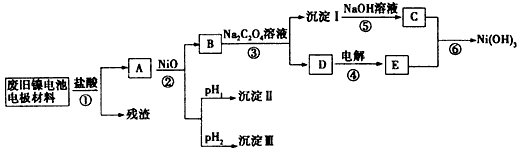
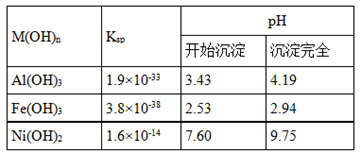
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图①中正极附近溶液pH降低 |
| B.图①中电子由Zn流向Cu,盐桥中的Cl—移向CuSO4溶液 |
C.图②正极反应是O2+2H2O+4e¯ 4OH¯ 4OH¯ |
| D.图②中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图1为原电池装置,Cu电极上产生的是O2 |
| B.图2装置中Cu电极上发生的电极反应式为:Cu-2e-===Cu2+ |
| C.由实验现象可知:金属活动性Cu>Cr |
| D.两个装置中,电子均由Cr电极流向Cu电极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在使用过程中,电池负极区溶液的pH减小 |
| B.使用过程中,电子由Ag2O极经外电路流向Zn极 |
| C.Zn是负极,Ag2O是正极 |
| D.Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com